题目内容
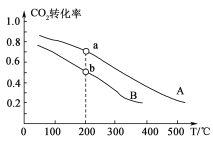
【题目】![]() 的分解受多种因素的影响。实验测得
的分解受多种因素的影响。实验测得![]() 时不同条件下,
时不同条件下,![]() 浓度随时间变化如图所示,下列说法不正确的是
浓度随时间变化如图所示,下列说法不正确的是
A.图甲表明,其他条件相同时,![]() 的浓度越小,其分解速率越慢
的浓度越小,其分解速率越慢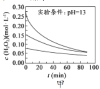
B.图乙表明,其他条件相同时,溶液pH越小,![]() 分解速率越慢
分解速率越慢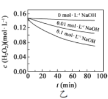
C.图丙表明,少量![]() 存在时,溶液碱性越强,
存在时,溶液碱性越强,![]() 分解速率越快
分解速率越快
D.图丙和图丁表明,碱性溶液中,![]() 对
对![]() 分解速率的影响大
分解速率的影响大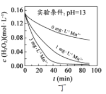
【答案】C
【解析】
![]() 图甲中溶液的pH相同,但浓度不同,浓度越大,相同时间内浓度的变化量越大,由此得出相同pH条件下,
图甲中溶液的pH相同,但浓度不同,浓度越大,相同时间内浓度的变化量越大,由此得出相同pH条件下,![]() 的浓度越小,其分解速率越慢,故 A正确;
的浓度越小,其分解速率越慢,故 A正确;
B.图乙中相同时间内双氧水浓度变化量:![]() 溶液
溶液![]() 溶液
溶液![]() 溶液,由此可知溶液pH越小,
溶液,由此可知溶液pH越小,![]() 分解速率越慢,故 B正确;
分解速率越慢,故 B正确;
C.图丙中少量![]() 存在时,相同时间内双氧水浓度变化量:
存在时,相同时间内双氧水浓度变化量:![]() 溶液
溶液![]() 溶液
溶液![]() 溶液,由此可知锰离子作催化剂时受溶液pH的影响,但与溶液的pH值不成正比,故C错误;
溶液,由此可知锰离子作催化剂时受溶液pH的影响,但与溶液的pH值不成正比,故C错误;
D.图丙、丁中pH相同,锰离子浓度越大,相同时间内双氧水浓度变化量越大,由此可知碱性溶液中,![]() 对
对![]() 分解速率的影响大,故D正确;
分解速率的影响大,故D正确;
故选:C。

【题目】短周期元素W、X 、Y 和Z 在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1) X在元素周期表中的位置为_______;画出X的简单离子结构示意图_______。
已知X元素的一种原子,其中子数为10,写出这种原子的原子符号_____________。
(2)四种元素简单离子的半径由大到小为_____________(用离子符号表达)。
(3)W、X的最简单氢化物稳定性为_______>________(填化学式)。
(4)Z最高价氧化物的水化物与Y最高价氧化物对应水化物反应的化学方程式为______ 。
(5)ZX2气体是一种广谱杀菌消毒剂。工业上可利用NaZX3和NaZ 在酸性条件下制得ZX2 同时得到Z元素的单质,该反应的离子方程式为_____________。
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
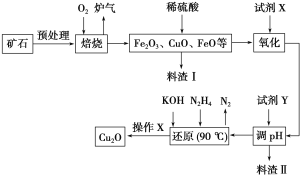
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________。
(4)写出用N2H4制备Cu2O的化学方程式:________,操作X包括_________、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。