题目内容
【题目】实验室模拟氨催化氧化法制硝酸的装置如图所示。下列说法错误的是
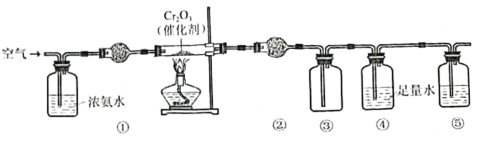
A.装置①、②、⑤依次盛装碱石灰、P2O5、NaOH溶液
B.装置③中产生红棕色气体
C.装置④中溶液可使紫色石蕊溶液变红,说明有HNO3生成
D.通空气的主要作用是鼓出氨气,空气可用N2代替
【答案】D
【解析】
空气通入浓氨水后,氨气和氧气的混合气体经过碱性干燥剂干燥后进入装有催化剂的硬质玻璃管,发生催化氧化产生NO,生成的气体经过酸性干燥剂(或无水氯化钙),除去氨气和水蒸气,在装置③中NO与空气中的氧气反应生成NO2,并收集,④中的水可以吸收排出的二氧化氮产生硝酸,尾气中的NO2、NO在⑤中被吸收,防止污染,因此⑤中可以选用氢氧化钠溶液,以此解答该题。
A.根据上述分析,装置①、②、⑤可依次盛装碱性干燥剂、酸性干燥剂、NaOH溶液,碱石灰为碱性干燥剂,可以干燥氨气,P2O5属于酸性干燥剂可以吸收氨气并干燥,故A正确;
B.装置③中NO被氧化生成NO2,气体呈红棕色,故B正确;
C.装置④中发生3NO2+H2O=2HNO3+NO,溶液显酸性,可使紫色石蕊溶液变红,故C正确;
D.通空气的主要作用是鼓出氨气并提供氧气,空气不能用N2代替,故D错误;
故选:D。

 阅读快车系列答案
阅读快车系列答案【题目】某化学小组同学探究在实验室中![]() 检验的干扰因素。
检验的干扰因素。
(1)检验溶液中是否含有![]() 时先用过量盐酸将溶液酸化,其目的是排除_______________、
时先用过量盐酸将溶液酸化,其目的是排除_______________、![]() 、Ag+等离子可能造成的干扰。
、Ag+等离子可能造成的干扰。
(2)为了验证盐酸能否排除![]() 的干扰,该小组同学进行了如下实验:
的干扰,该小组同学进行了如下实验:
Ⅰ.量取一定体积的浓盐酸(盛放浓盐酸试剂瓶的标签中部分信息如下图),稀释,配制成 5 mol/L 的稀盐酸。

Ⅱ.甲同学取 0.3 g 未变质的 Na2SO3 固体,向其中加入上述 5mol/L 稀盐酸至过量,产生大量气泡。充分振荡后滴加 4 滴BaCl2 溶液,迅速产生白色浑浊,产生白色浑浊的原因可能是:
①______________。
②盐酸中含有 Fe3+,实验证实含有 Fe3+的方案是:___________________,用离子方程式解释由 Fe3+产生白色浑浊的原因:__________。
(3)乙同学提出,检验![]() 时能否用硝酸酸化来排除
时能否用硝酸酸化来排除![]() 的干扰,丙同学认为不可行,理由是(用离子方程式表示)____________________________,继续实验:称取 5 份 0.3 g 未变质的Na2SO3 固体,分别向其中加入 10 mL 不同浓度的硝酸, 振荡;再滴加 4 滴BaCl2 溶液,观察并记录实验现象如下表。
的干扰,丙同学认为不可行,理由是(用离子方程式表示)____________________________,继续实验:称取 5 份 0.3 g 未变质的Na2SO3 固体,分别向其中加入 10 mL 不同浓度的硝酸, 振荡;再滴加 4 滴BaCl2 溶液,观察并记录实验现象如下表。
硝酸浓度(mol/L) | 滴加氯化钡溶液之前现象 | 滴加氯化钡溶液之后现象 |
15.0(浓硝酸) | 产生大量红棕色气体,溶液呈黄色 | 立即产生大量白色沉淀 |
7.5 | 产生大量红棕色气体,溶液呈淡黄色 | 立即产生大量白色沉淀 |
4.8 | 产生少量无色、刺激性气味气体,溶液无色 | 开始无现象,约 60 min 后溶液开始变浑浊 |
2.0 | 产生少量无色、刺激性气味气体,溶液无色 | 开始无现象,约 70 min 后溶液开始变浑浊 |
0.5 | 产生少量无色、刺激性气味气体,溶液无色 | 开始无现象,约 120 min 后溶液开始变浑浊 |
依据上述实验得出的结论是:________________。
(4)丙同学查阅资料后提出:Cl-的存在也会对![]() 的检验产生干扰。在 Cl-催化作用下,稀硝酸可将
的检验产生干扰。在 Cl-催化作用下,稀硝酸可将![]() 氧化为
氧化为 ![]() 。为证明上述观点,设计如下实验,请将实验ⅱ的操作补充完整。
。为证明上述观点,设计如下实验,请将实验ⅱ的操作补充完整。
实验 | 实验操作 | 实验现象 |
ⅰ | 将 0.3 g Na2SO3 和 0.3 g NaCl 固体混合,加入 10 mL 2.0mol/L 的稀硝酸,振荡后,再滴加 4 滴 BaCl2 溶液。 | 立即产生大量白色沉淀。 |
ⅱ | ____________。 | 放置两小时后溶液未变浑浊。 |