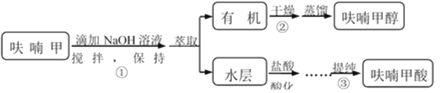
��Ŀ����
����Ŀ��������ѧ֪ʶ�ش��������⣮
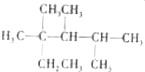
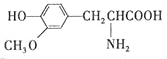
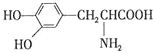
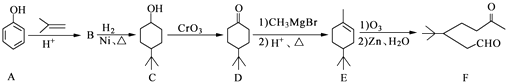
��1��0.5molCH4�к�����������ӣ������ӵ�������NA��ʾ�����ڱ�״���µ����Ϊ L��0.1molH2SO4�к� molHԭ�ӣ�����ˮ���100mLˮ��Һ��c��H+��= ��
��2���ڷ�Ӧ3Zn+2Fe3+�T3Zn2++2Fe�У�Fe3+�������������ԭ��������1molZn��ȫ��Ӧת�Ƶĵ�����Ϊ mol��
��3��ѡ������ʵ�鷽���������ʣ������뷽����������ں����ϣ���ѡ����
A����ȡ��Һ B������ C���ᾧ D����Һ E������ F������
�ٷ�������л��е���ɳ �� �ڷ�����ˮ�Ļ���� ��
�۷���ˮ�����͵Ļ���� �� �ܷ���ƾ���ˮ�Ļ���� ��
��4���������������ʢ�CaO��SO3��SO2��P2O5 ��HNO3��H2SO4��HCl��NaCl��KClO3��KCl��KMnO4��HgO�����о���һ����������������������ʲ�ͬ�����������ʷֱ��ǣ����������� ��
���𰸡�
��1��0.5NA��11.2��0.2��2mol/L
��2��������2
��3��F��A��D��E
��4��CaO��NaCl��HgO
���������⣺��1��0.5mol CH4�к���0.5NA��������ӣ������ӵ�������NA��ʾ�����ڱ�״���µ����Ϊ0.5mol��22.4L/mol=11.2L��0.1molH2SO4�к�0.2molHԭ�ӣ�����ˮ���100mLˮ��Һ���C��H+��= ![]() =2mol/L�����Դ��ǣ�0.5NA��11.2L��0.2��2mol/L����2���ڷ�Ӧ3Zn+2Fe3+�T3Zn2++2Fe�У�FeԪ�ػ��ϼ���+3�۽��͵�0�ۣ�Fe3+Ϊ��������ZnԪ�ػ��ϼ���0�����ߵ�+2�ۣ�1molZn��ȫ��Ӧת�Ƶĵ�����Ϊ2mol���ӣ�
=2mol/L�����Դ��ǣ�0.5NA��11.2L��0.2��2mol/L����2���ڷ�Ӧ3Zn+2Fe3+�T3Zn2++2Fe�У�FeԪ�ػ��ϼ���+3�۽��͵�0�ۣ�Fe3+Ϊ��������ZnԪ�ػ��ϼ���0�����ߵ�+2�ۣ�1molZn��ȫ��Ӧת�Ƶĵ�����Ϊ2mol���ӣ�
���Դ��ǣ�������2����3����NaCl������ˮ������ɳ���ܣ����ù��˵ķ������룬���Դ��ǣ�F���ڵ������ڱ����л��ܼ���������ȡ�ķ������룬���Դ��ǣ�A����ˮ�����ͻ������ܣ����÷�Һ�ķ������룬���Դ��ǣ�D���ܾƾ���ˮ���ܣ���������ķ������룬����ʱ�ڻ��Һ�м���CaO���ʯ�ң�Ȼ�����пɽ����߷��룬���Դ��ǣ�E����4����CaOΪ���������SO3��SO2��P2O5��Ϊ�����������HNO3��H2SO4��HCl��Ϊ�ᣬ��NaCl�����Σ���KClO3��KCl��KMnO4��Ϊ�Σ���HgO������������Դ��ǣ�CaO��NaCl��HgO��

����Ŀ������ԭCO2�ǽ������ЧӦ����Դ�������Ҫ�ֶ�֮һ���о���������Cu/ZnO���������£�CO2��H2�ɷ�������ƽ�з�Ӧ���ֱ�����CH3OH��CO����Ӧ���Ȼ�ѧ����ʽ���£�
CO2��g��+3H2��g��CH3OH��g��+H2O��g����H1=��53.7kJmol��1 ��
CO2��g��+H2��g��CO��g��+H2O��g����H2 ��
ijʵ���ҿ���CO2��H2��ʼͶ�ϱ�Ϊ1��2.2������ͬѹǿ�£�������ͬ��Ӧʱ��������ʵ�����ݣ�
T��K�� | ���� | CO2ת���ʣ�%�� | �״�ѡ���ԣ�%�� |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[��ע]Cat.1��Cu/ZnO���װ���Cat.2��Cu/ZnO����Ƭ���״�ѡ���ԣ�ת����CO2�����ɼ״��İٷֱ�
��֪����CO��H2�ı�ȼ���ȷֱ�Ϊ��283.0kJmol��1�ͩ�285.8kJmol��1 ��
��H2O��1���TH2O��g����H3=44.0kJmol��1
��ش𣨲������¶ȶԡ�H��Ӱ�죩��
��1����ӦI��ƽ�ⳣ������ʽK=����Ӧ��ġ�H2=kJmol��1 ��
��2�����������CO2ת��ΪCH3OHƽ��ת���ʵĴ�ʩ�� ��
A.ʹ�ô���Cat.1
B.ʹ�ô���Cat.2
C.���ͷ�Ӧ�¶�
D.Ͷ�ϱȲ��䣬���ӷ�Ӧ���Ũ��
E.���� CO2��H2�ij�ʼͶ�ϱ�
��3������ʵ�����ݱ���������ͬ�¶��²�ͬ�Ĵ�����CO2ת����CH3OH��ѡ������������Ӱ�죬��ԭ���� ��
��4������ͼ�зֱ���ӦI����������Cat.1����Cat.2��������¡���Ӧ���̩�������ʾ��ͼ��
��5���о�֤ʵ��CO2Ҳ��������ˮ��Һ��ͨ��������ɼ״��������ɼ״��ķ�Ӧ�����������õ缫��Ӧʽ�� ��