题目内容
【题目】常温下,向20mL0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/LHCl溶液40mL,溶液中含碳元素的各种微粒(CO2逸出未画出)的物质的量分数随溶液pH变化的部分情况如图所示,下列说法错误的是( )

A.在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存
B.已知在25℃,CO32-的水解平衡常数Kh1=2×10-4,当溶液的pH=10时,溶液中c(HCO3-):c(CO32-)=2:1
C.pH=7时溶液中各种离子其物质的量浓度的大小关系是c(Na+)>c(HCO3-)>c(Cl-)>c(H+)=c(OH-)>c(CO32-)
D.当混合液pH≈6时,开始放出CO2气体
【答案】C
【解析】
A.由图可知,pH在8~12存在HCO3-、CO32-,pH<8存在H2CO3、HCO3-,可知上述反应的同一溶液中,H2CO3、HCO3-、CO32-不能大量共存,故A正确;
B.CO32-的水解平衡常数Kh1=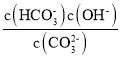 ,当溶液的pH=10时,c(OH-)=10-4mol/L,Kh1=2×10-4,则溶液中c(HCO3-):c(CO32-)=2:1,B正确;
,当溶液的pH=10时,c(OH-)=10-4mol/L,Kh1=2×10-4,则溶液中c(HCO3-):c(CO32-)=2:1,B正确;
C.由图可知pH=7时c(H+)=c(OH-),c(HCO3-)>c(CO32-),且溶液含H2CO3,则溶质为NaCl、NaHCO3、H2CO3,则存在c(Na+)>c(Cl-)>c(HCO3-),C错误;
D.由图可知,pH=7时溶液含H2CO3,若酸性增强,释放二氧化碳,则混合液pH≈6时,开始放出CO2气体,D正确;
故合理选项是C。

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目

