题目内容
镁铁混合物4.9g,溶解在过量某浓度的稀硝酸中,完全反应得到标况下气体2.24L(假设气体全为NO),则向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量为( )A.6g
B.8g
C.10g
D.12g
【答案】分析:m(沉淀)=m(混合物)+m(OH-),反应中存在:Mg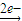 Mg2+
Mg2+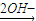 Mg(OH)2,Fe
Mg(OH)2,Fe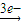 Fe3+
Fe3+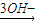 Fe(OH)3,
Fe(OH)3,
得出n(e-)=n(OH-),以此计算沉淀的质量.
解答:解:n(NO)=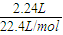 =0.1mol,
=0.1mol,
生成0.01molNO,转移的电子的物质的量为:n(e-)=0.1mol×(5-2)=0.3mol,
反应中存在:Mg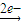 Mg2+
Mg2+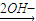 Mg(OH)2,Fe
Mg(OH)2,Fe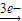 Fe3+
Fe3+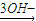 Fe(OH)3,
Fe(OH)3,
则n(e-)=n(OH-),
又m(沉淀)=m(混合物)+m(OH-),
所以:m(沉淀)=4.9g+0.3mol×17g/mol=10g,
故选C.
点评:本题考查混合物的计算,题目难度中等,解答本题注意从电子守恒和质量守恒的角度分析,找出电子与氢氧根离子的物质的量的关系是解答本题的关键,可起到事半功倍的效果.
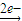 Mg2+
Mg2+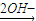 Mg(OH)2,Fe
Mg(OH)2,Fe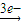 Fe3+
Fe3+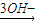 Fe(OH)3,
Fe(OH)3,得出n(e-)=n(OH-),以此计算沉淀的质量.
解答:解:n(NO)=
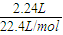 =0.1mol,
=0.1mol,生成0.01molNO,转移的电子的物质的量为:n(e-)=0.1mol×(5-2)=0.3mol,
反应中存在:Mg
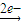 Mg2+
Mg2+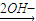 Mg(OH)2,Fe
Mg(OH)2,Fe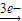 Fe3+
Fe3+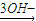 Fe(OH)3,
Fe(OH)3,则n(e-)=n(OH-),
又m(沉淀)=m(混合物)+m(OH-),
所以:m(沉淀)=4.9g+0.3mol×17g/mol=10g,
故选C.
点评:本题考查混合物的计算,题目难度中等,解答本题注意从电子守恒和质量守恒的角度分析,找出电子与氢氧根离子的物质的量的关系是解答本题的关键,可起到事半功倍的效果.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
|
镁铁混合物4.9g,溶解在过量某浓度的稀硝酸中,完全反应得到标况下气体2.24L(假设气体全为NO),则向反应后的溶液中加入足量的烧碱,则可生成沉淀的量是 | |
| [ ] | |
A. |
6g |
B. |
8g |
C. |
10g |
D. |
12g |