题目内容
【题目】氢能将成为21世纪的主要能源。太阳能光伏电池电解水可制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。
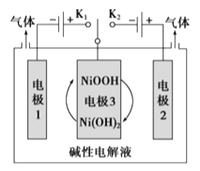
(1)制H2时,连接________(填“K1”或“K2”),产生H2的电极反应式是____________,溶液pH___________(填“增大”、“减小”或“不变”)。
(2)改变开关连接方式,可得O2,此时电极3的反应式为:__________________。
【答案】K1 2H2O+2e-=H2↑+2OH- 增大 NiOOH+H2O+e-=Ni(OH)2+OH-
【解析】
电解水生成氢气和氧气,氧气在阳极生成,氢气在阴极生成,则制H2时,应连接K1,电极1为阴极,电极反应式为2H2O+2e-=H2↑+2OH-,电极3为阳极,电极反应式为Ni(OH)2-e-+OH-=NiOOH+H2O;制O2时,连接K2,电极2为阳极,电极反应式为4OH--4e-=O2↑+2H2O,电极3为阴极,电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,从而实现NiOOHNi(OH)2的转化,且可循环使用。
(1)电解水生成氢气和氧气,氧气在阳极生成,氢气在阴极生成,则制H2时,应连接K1,电极反应式为2H2O+2e-=H2↑+2OH-,溶液pH增大;
故答案为:K1;2H2O+2e-=H2↑+2OH-;增大;
(2)制O2时,连接K2,电极3为阴极,发生反应NiOOH+H2O+e-=Ni(OH)2+OH-,从而实现NiOOHNi(OH)2的转化,且可循环使用;
故答案为:NiOOH+H2O+e-=Ni(OH)2+OH-。

【题目】一定温度下,向2L恒容容器中充入1molA和1molB,发生反应A(g)+B(g)=C(g)经过一段时间后达到平衡,反应过程中测定的部分数据如表。下对说法正确的是( )
t/s | 0 | 5 | 15 | 25 | 35 | ||
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 | ||
A. 前 5 s 的平均反应速率v(A)=0.03 mol·L-1·s-1
B. 正反应是吸热反应
C. 保持温度不变,起始时向容器中充入2molC,达平衡时,C的转化率大于80%
D. 保持温度不变,起始时向容器中充入0.2molA、0.2molB和1molC, 反应达到平衡前v(正)<v(逆)