题目内容
1.下列说法正确的是( )| A. | 反应Na→Na2O→Na2O2中钠元素被连续氧化 | |
| B. | 1mol金属钠发生反应Na→Na2O和发生反应Na→Na2O2转移电子数相等 | |
| C. | 1molCl2与足量Fe反应转移3mol电子 | |
| D. | 将1molCl2通入1L水中转移的电子为1mol |
分析 A.根据元素化合价升高被氧化判断;
B.根据钠发生反应Na→Na2O和发生反应Na→Na2O2都是由0价升高到+1价分析;
C.根据氯气被铁还原成-1价氯计算;
D.氯气与水反应为可逆反应,不能反应到底.
解答 解:A.反应Na→Na2O钠元素化合价升高被氧化,Na2O→Na2O2中钠元素化合价不变没有被氧化,故A错误;
B.钠发生反应Na→Na2O和发生反应Na→Na2O2都是由0价升高到+1价,所以1mol金属钠发生反应Na→Na2O和发生反应Na→Na2O2转移电子数,故B正确;
C.因为氯气被铁还原成-1价氯,所以1molCl2与足量Fe反应转移2mol电子,故C错误;
D.氯气与水反应为可逆反应,不能反应到底,所以1molCl2通入1L水中转移的电子小于1mol,故D错误;
故选B.
点评 本题考查了氧化还原反应,根据元素化合价变化结合基本概念分析解答,注意氯气与水反应为可逆反应,不能反应到底,为易错点.

练习册系列答案
相关题目
11.下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A. | 碱性氧化物--氧化铁--FeO | B. | 酸性氧化物--碳酸--C0 | ||
| C. | 酸--硫酸--H2S | D. | 盐--纯碱--Na2CO3 |
12.关于实验室制取乙烯的实验中,下列说法正确的是( )
| A. | 浓硫酸起吸水和催化作用 | B. | 药品加入顺序为:浓硫酸→乙醇 | ||
| C. | 反应原理是取代反应 | D. | 温度计水银球应该插入溶液中 |
9.下列各组离子,在溶液中可以大量共存的是( )
| A. | Na+、Ba2+、SO${\;}_{4}^{2-}$ | B. | K+、H+、OH- | ||
| C. | H+、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$ | D. | Na+、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ |
16.在pH=1的溶液中,因发生氧化还原反应而不能大量共存的离子组是( )
| A. | Ca2+、Cl-、HCO3-、K+ | B. | ClO-、K+、SO42-、Ba2+ | ||
| C. | CH3COO-、K+、Na+、CO32- | D. | Fe2+、Ag+、NO3-、K+ |
6.把100g某浓度的NaOH溶液(ρ=1.20g/cm3)蒸发浓缩,余下溶液50mL,物质的量浓度为8mol/L,则原溶液的物质的量浓度为( )
| A. | 2.80 mol•L-1 | B. | 3.20mol•L-1 | C. | 4.0 mol•L-1 | D. | 4.80mol•L-1 |
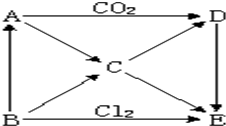 下图表示A~E五种物质间的相互转化关系,其中A为淡黄色固体,B为金属单质.试推出各物质的化学式,并写出有关反应的化学方程式.
下图表示A~E五种物质间的相互转化关系,其中A为淡黄色固体,B为金属单质.试推出各物质的化学式,并写出有关反应的化学方程式.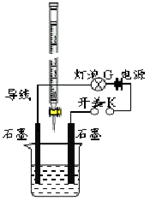 某温度下,水的离子积Kw=l×10-13.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.
某温度下,水的离子积Kw=l×10-13.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.