��Ŀ����
����Ŀ�����÷�����X��ϩ��Y���Ժϳ����������ռ�BAD�� ��֪��G���ܷ���������Ӧ��B��FeCl3��Һ����ɫ��C��D�Ĺ���Ϊ�����Ȼ�����COOH���ķ�Ӧ������BAD�ṹ��ʽΪ�� 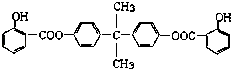
BAD�ĺϳ�·�����£�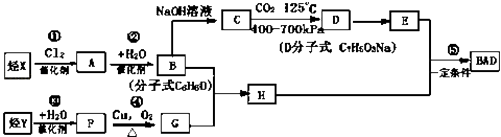
�Իش��������⣺
��1��д���ṹ��ʽYD ��
��2�����ڼӳɷ�Ӧ���У���������ţ� ��
��3��1molBAD�����뺬molNaOH����Һ��ȫ��Ӧ��
��4��д������ʽ��Ӧ�� �� F+E ��
��5��E�ж���ͬ���칹�壬�жϷ�������Ҫ���ͬ���칹����ĿΪ�֣� ���ܷ���������Ӧ����FeCl3��Һ����ɫ�ۺ˴Ź�������ͼ�����ĸ����շ壮
���𰸡�
��1��CH3CH=CH2��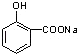
��2����
��3��6
��4�� ��
��
��5��3
���������⣺C��D�Ĺ���Ϊ�����Ȼ�����COOH���ķ�Ӧ����ת����ϵ��֪E�����Ȼ������BAD�ṹ��ʽ��֪EΪ 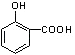 ��HΪ
��HΪ 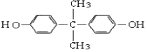 ������D�ķ���ʽ���E�Ľṹ��֪DΪ
������D�ķ���ʽ���E�Ľṹ��֪DΪ 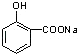 ���ٸ���B�ķ���ʽ��֪BΪ
���ٸ���B�ķ���ʽ��֪BΪ ![]() ����AΪ
����AΪ ![]() ����XΪ
����XΪ ![]() ��F��CuΪ���������·�������������G��G���ܷ���������Ӧ�����B��H�Ľṹ��֪GΪ
��F��CuΪ���������·�������������G��G���ܷ���������Ӧ�����B��H�Ľṹ��֪GΪ 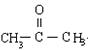 ����FΪCH3CH��OH��CH3 �� ��YΪCH3CH=CH2 �� ��1��������������֪��Y�Ľṹ��ʽΪCH3CH=CH2 �� D�Ľṹ��ʽΪ��
����FΪCH3CH��OH��CH3 �� ��YΪCH3CH=CH2 �� ��1��������������֪��Y�Ľṹ��ʽΪCH3CH=CH2 �� D�Ľṹ��ʽΪ�� 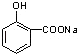 �� �ʴ�Ϊ��CH3CH=CH2��
�� �ʴ�Ϊ��CH3CH=CH2��  ����2����ת����ϵ��֪����Ϊȡ����Ӧ����Ϊȡ����Ӧ����Ϊ�ӳɷ�Ӧ����Ϊ������Ӧ����Ϊȡ����Ӧ��
����2����ת����ϵ��֪����Ϊȡ����Ӧ����Ϊȡ����Ӧ����Ϊ�ӳɷ�Ӧ����Ϊ������Ӧ����Ϊȡ����Ӧ��
�ʴ�Ϊ���ۣ���3������BAD�ṹ��ʽ��֪��BADˮ������4�����ǻ���2���Ȼ�����1molBAD�����뺬6molNaOH����Һ��Ӧ��
�ʴ�Ϊ��6����4����Ӧ�ܵķ�Ӧ����ʽΪ�� 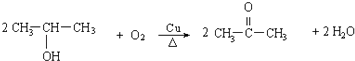 ��
��
F+E��Ӧ����ʽΪ��  ��
��
�ʴ�Ϊ�� 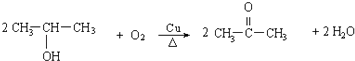 ��
��  ����5��E��
����5��E�� 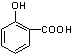 ����ͬ���칹�����������ʣ�����FeCl3��Ӧ����Һ����ɫ��˵�����з��ǻ������ܷ���������Ӧ��˵������ȩ�����ۺ˴Ź�������ͼ�����ĸ����շ壬˵�������������4��Hԭ�ӣ�����������ͬ���칹��Ľṹ��ʽ�У�
����ͬ���칹�����������ʣ�����FeCl3��Ӧ����Һ����ɫ��˵�����з��ǻ������ܷ���������Ӧ��˵������ȩ�����ۺ˴Ź�������ͼ�����ĸ����շ壬˵�������������4��Hԭ�ӣ�����������ͬ���칹��Ľṹ��ʽ�У� ![]() ��
�� 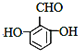 ��
�� ![]() ��
��
�ʴ�Ϊ��3��
C��D�Ĺ���Ϊ�����Ȼ�����COOH���ķ�Ӧ����ת����ϵ��֪E�����Ȼ������BAD�ṹ��ʽ��֪EΪ 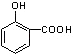 ��HΪ
��HΪ 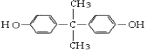 ������D�ķ���ʽ���E�Ľṹ��֪DΪ
������D�ķ���ʽ���E�Ľṹ��֪DΪ  ���ٸ���B�ķ���ʽ��֪BΪ
���ٸ���B�ķ���ʽ��֪BΪ ![]() ����AΪ
����AΪ ![]() ����XΪ
����XΪ ![]() ��F��CuΪ���������·�������������G��G���ܷ���������Ӧ�����B��H�Ľṹ��֪GΪ
��F��CuΪ���������·�������������G��G���ܷ���������Ӧ�����B��H�Ľṹ��֪GΪ 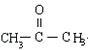 ����FΪCH3CH��OH��CH3 �� ��YΪCH3CH=CH2 �� �ݴ˽��
����FΪCH3CH��OH��CH3 �� ��YΪCH3CH=CH2 �� �ݴ˽��

����Ŀ��SO2�ĺ����ǿ��������ձ���һ����Ҫ���ָ�꣬������ѧ֪ʶ�ش��������⣮
��1����ҵ����������У�SO2��������ԭ��Ϊ�� 2SO2��g��+O2��g�� ![]() 2SO3��g��
2SO3��g��
T��ʱ����ij�ܱ������г���һ��SO2��g����O2��g��������������Ӧ�����SO2��g����ƽ��ת���ʣ�a������ϵ��ѹǿ��p���Ĺ�ϵ��ͼ1��ʾ��
��a��b�����Ӧ��ƽ�ⳣ��K��a��K��b�������������������=������ͬ����SO2Ũ��c��a��c��b����
��c��ʱ����Ӧ����v������v���棩 ��
��2���绯ѧ������SO2 �� ���Ṥҵβ���е�SO2������������Ʊ����ᣬͬʱ��õ��ܣ�װ����ͼ2��ʾ���缫��Ϊ���Բ��ϣ���
��M�������ĵ缫��ӦʽΪ ��
����ʹ��װ�õĵ���ǿ�ȴﵽ2.0A��������ÿ����Ӧ��ͨ���״������������ΪL����֪��1��e����������Ϊ1.6��10��19C����
��3����Һ������SO2 �� ��֪������H2SO3��H2CO3�ĵ��볣�������ʾ��
���볣�� | K1 | K2 |
H2SO3 | 1.3��10��2 | 6.3��10��8 |
H2CO3 | 4.2��10��7 | 5.6��10��11 |
�����£���SO2����ͨ��100mL 0.2molL��1��Na2CO3��Һ�У���ͨ��448mLSO2ʱ��������Ϊ��״���µ��������ͬ�������������ӷ���ʽΪ����ͨ��896mLSO2ʱ��������Һ�������ԣ���Һ�и�����Ũ���ɴ�С��˳��Ϊ
