题目内容
已知氨水与醋酸的电离程度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①
N+H2O NH3·H2O+H+②
NH3·H2O+H+②
H++OH- H2O③
H2O③
由于N水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①
N+OH- NH3·H2O②
NH3·H2O②
由于NH4Cl电离出的N与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学解释只有一种正确,他选用的试剂是 (填写编号)。
(2)请你说明丙同学作出该选择的理由是 。
(3)丙同学将所选试剂滴入Mg(OH)2悬浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 (填“甲”或“乙”);写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
甲同学的解释是:
Mg(OH)2(s)
 Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①N+H2O
 NH3·H2O+H+②
NH3·H2O+H+②H++OH-
 H2O③
H2O③由于N水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:
Mg(OH)2(s)
 Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①N+OH-
 NH3·H2O②
NH3·H2O②由于NH4Cl电离出的N与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学解释只有一种正确,他选用的试剂是 (填写编号)。
| A.NH4NO3 | B.CH3COONH4 |
| C.Na2CO3 | D.NH3·H2O |
(3)丙同学将所选试剂滴入Mg(OH)2悬浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 (填“甲”或“乙”);写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
(1)B
(2)CH3COONH4溶液呈中性,滴入Mg(OH)2悬浊液中,若Mg(OH)2悬浊液溶解,则说明乙同学解释正确,若Mg(OH)2不溶解,则甲同学解释正确
(3)乙 Mg(OH)2+2N Mg2++2NH3·H2O
Mg2++2NH3·H2O
(2)CH3COONH4溶液呈中性,滴入Mg(OH)2悬浊液中,若Mg(OH)2悬浊液溶解,则说明乙同学解释正确,若Mg(OH)2不溶解,则甲同学解释正确
(3)乙 Mg(OH)2+2N
 Mg2++2NH3·H2O
Mg2++2NH3·H2O因为NH4Cl溶液呈酸性,故有甲、乙两位同学的解释,现在可以选择中性的CH3COONH4溶液,滴入Mg(OH)2悬浊液中,若Mg(OH)2溶解,则说明乙同学解释正确,若Mg(OH)2不溶解,则说明甲同学解释正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 )=(Ksp)
)=(Ksp)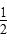
 )≠Ksp,c(Ba2+)<c(SO
)≠Ksp,c(Ba2+)<c(SO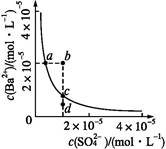
 Ba2+(aq)+S(aq)的平衡常数Ksp=c(Ba2+)·c(S),称为溶度积常数。
Ba2+(aq)+S(aq)的平衡常数Ksp=c(Ba2+)·c(S),称为溶度积常数。