题目内容
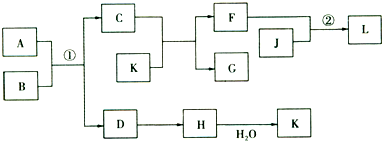
物质A、B、C、D等的转化关系如图所示.已知A是由两种元素组成的化合物,B是常见的气态单质,J是常见的金属单质,H的相对分子质量比D大16(部分反应物、生成物未列出),反应①是工业上制取K的第一步反应,反应②为化合反应.
依据上述信息,回答下列的问题:
(1)J在元素周期表中的位置是 .
(2)F的水溶液显 (填“酸”、“碱”或“中”)性,用相关的离子方程式表示 .
(3)反应①的化学方程式为 .工业上反应①在 (填工业设备名称)中进行.
(4)反应②的离子方程式为 .

依据上述信息,回答下列的问题:
(1)J在元素周期表中的位置是
(2)F的水溶液显
(3)反应①的化学方程式为
(4)反应②的离子方程式为
分析:此题的题眼是H的相对分子质量比D大16,H能与水反应,可知符合H、D的物质主要有一下几组:一氧化碳和二氧化碳;一氧化氮和二氧化氮;氧化钠和过氧化钠;二氧化硫和三氧化硫;题中给出信息A为固体,F是盐,反应①是工业上制取K的重要反应,很明显推得K是硫酸,A是FeS2,则B为O2,C为Fe2O3,D为SO2,H为SO3,由K和C的反应可知F为Fe2(SO4)3,G为H2O,J是常见的金属单质,可与Fe2(SO4)3发生化合反应,则J为Fe,L为FeSO4,结合对应物质的性质以及题目要求解答该题.
解答:解:H的相对分子质量比D大16,H能与水反应,可知符合H、D的物质主要有一下几组:一氧化碳和二氧化碳;一氧化氮和二氧化氮;氧化钠和过氧化钠;二氧化硫和三氧化硫;题中给出信息A为固体,F是盐,反应①是工业上制取K的重要反应,很明显推得K是硫酸,A是FeS2,则B为O2,C为Fe2O3,D为SO2,H为SO3,由K和C的反应可知F为Fe2(SO4)3,G为H2O,J是常见的金属单质,可与Fe2(SO4)3发生化合反应,则J为Fe,L为FeSO4,则
(1)由以上分析可知J为Fe,位于周期表第四周期、第Ⅷ族,故答案为:第四周期、第Ⅷ族;
(2)F为Fe2(SO4)3,为强酸弱碱盐,水解呈酸性,发生Fe3++3H2O?Fe(OH)3+3H+,故答案为:酸;Fe3++3H2O?Fe(OH)3+3H+;
(3)反应①为FeS2和O2的反应,方程式为4FeS2+1102
2Fe2O3+8SO2,在沸腾炉中进行,故答案为:4FeS2+1102
2Fe2O3+8SO2;沸腾炉;
(4)反应②的离子方程式为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+.
(1)由以上分析可知J为Fe,位于周期表第四周期、第Ⅷ族,故答案为:第四周期、第Ⅷ族;
(2)F为Fe2(SO4)3,为强酸弱碱盐,水解呈酸性,发生Fe3++3H2O?Fe(OH)3+3H+,故答案为:酸;Fe3++3H2O?Fe(OH)3+3H+;
(3)反应①为FeS2和O2的反应,方程式为4FeS2+1102
| ||
| ||
(4)反应②的离子方程式为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+.
点评:本题以元素化合物的推断为载体考查了元素化合物的性质,通过元素化合物的推断考查学生的推理、分析、判断等能力,解答本题的关键点为物质的相对分子质量关系以及工业生成的特点,注意把握相关物质的性质和用途,难度中等.

练习册系列答案
相关题目

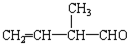 所含官能团的名称是
所含官能团的名称是