题目内容
将标准状况下的11.2L氨气溶于100mL水中,得到密度为0.868g?cm-3的氨水.
(1)该气体的物质的量=______mol;溶液的体积=______L;所得氨水的物质的量浓度=______ mol?L-1.
(2)若取上述氨水30.0mL与70.0mL2.00mol?L-1的AlCl3溶液相混合,产生白色沉淀的质量是______g.
(3)若取某浓度的NaOH溶液50.0mL与50.0mL2.00mol?L-1的AlCl3溶液相混合,有白色沉淀产生,测得溶液中铝元素与沉淀中铝元素质量相等,则NaOH溶液的物质的量浓度为______ mol?L-1.
(1). 3.12g.(3)解:(1)气体的物质的量为:n(NH3)=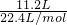 =0.500mol;
=0.500mol;
溶液的体积为: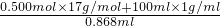 =125ml=0.125L;
=125ml=0.125L;
氨水的物质的量浓度:c(NH3)=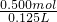 =4.00mol/L
=4.00mol/L
故答案为:0.500mol; 溶液的体积=0.125 L; 4.00mol?L-1
(2)氨水与的AlCl3溶液相混合,发生反应为:3NH3?H2O+AlCl3=Al(OH)3↓+3NH4Cl,经过量计算,AlCl3过量,根据NH3计算沉淀的质量,m[Al(OH)3]= ×0.03L×4.00mol/L×78g/mol=3.12g
×0.03L×4.00mol/L×78g/mol=3.12g
故答案为:3.12g.
(3)当溶液中铝元素以Al3+形式存在时,溶液中铝元素与沉淀中铝元素质量相等,所以,n(Al3+)=n[Al(OH)3]= n(AlCl3)=
n(AlCl3)= ×0.05L×2.00mol/L=0.05mol,根据离子守恒,n(NaOH)=3n[Al(OH)3]=3×0.05mol,c(NaOH)=
×0.05L×2.00mol/L=0.05mol,根据离子守恒,n(NaOH)=3n[Al(OH)3]=3×0.05mol,c(NaOH)=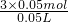 =3mol/L
=3mol/L
当溶液中铝元素以AlO2-形式存在时,溶液中铝元素与沉淀中铝元素质量相等,所以,n(AlO2-)=n[Al(OH)3]= n(AlCl3)=
n(AlCl3)= ×0.05L×2.00mol/L=0.05mol,根据离子守恒,n(NaOH)=n(AlO2-)+n(Cl-)=0.05mol+3×0.05L×2.00mol/L=0.35mol,c(NaOH)=
×0.05L×2.00mol/L=0.05mol,根据离子守恒,n(NaOH)=n(AlO2-)+n(Cl-)=0.05mol+3×0.05L×2.00mol/L=0.35mol,c(NaOH)=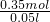 =7mol/L
=7mol/L
故答案为:3.00或7.00mol?L-1
分析:(1)根据n=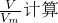 ;根据V=
;根据V=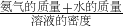 计算;根据C=
计算;根据C=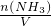 计算
计算
(2)先过量计算,再根据氨水的物质的量计算生成沉淀的质量.
(3)先判断溶液中的铝元素存在形式,再根据离子守恒计算.
点评:本题考查了物质的量浓度的有关计算,难度不大,如果在计算题中反应物的物理量都是已知的,注意要先进行过量计算,然后根据不足量的为标准计算即可.
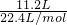 =0.500mol;
=0.500mol;溶液的体积为:
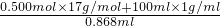 =125ml=0.125L;
=125ml=0.125L;氨水的物质的量浓度:c(NH3)=
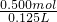 =4.00mol/L
=4.00mol/L故答案为:0.500mol; 溶液的体积=0.125 L; 4.00mol?L-1
(2)氨水与的AlCl3溶液相混合,发生反应为:3NH3?H2O+AlCl3=Al(OH)3↓+3NH4Cl,经过量计算,AlCl3过量,根据NH3计算沉淀的质量,m[Al(OH)3]=
 ×0.03L×4.00mol/L×78g/mol=3.12g
×0.03L×4.00mol/L×78g/mol=3.12g故答案为:3.12g.
(3)当溶液中铝元素以Al3+形式存在时,溶液中铝元素与沉淀中铝元素质量相等,所以,n(Al3+)=n[Al(OH)3]=
 n(AlCl3)=
n(AlCl3)= ×0.05L×2.00mol/L=0.05mol,根据离子守恒,n(NaOH)=3n[Al(OH)3]=3×0.05mol,c(NaOH)=
×0.05L×2.00mol/L=0.05mol,根据离子守恒,n(NaOH)=3n[Al(OH)3]=3×0.05mol,c(NaOH)=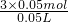 =3mol/L
=3mol/L当溶液中铝元素以AlO2-形式存在时,溶液中铝元素与沉淀中铝元素质量相等,所以,n(AlO2-)=n[Al(OH)3]=
 n(AlCl3)=
n(AlCl3)= ×0.05L×2.00mol/L=0.05mol,根据离子守恒,n(NaOH)=n(AlO2-)+n(Cl-)=0.05mol+3×0.05L×2.00mol/L=0.35mol,c(NaOH)=
×0.05L×2.00mol/L=0.05mol,根据离子守恒,n(NaOH)=n(AlO2-)+n(Cl-)=0.05mol+3×0.05L×2.00mol/L=0.35mol,c(NaOH)=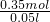 =7mol/L
=7mol/L故答案为:3.00或7.00mol?L-1
分析:(1)根据n=
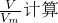 ;根据V=
;根据V=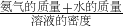 计算;根据C=
计算;根据C=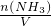 计算
计算(2)先过量计算,再根据氨水的物质的量计算生成沉淀的质量.
(3)先判断溶液中的铝元素存在形式,再根据离子守恒计算.
点评:本题考查了物质的量浓度的有关计算,难度不大,如果在计算题中反应物的物理量都是已知的,注意要先进行过量计算,然后根据不足量的为标准计算即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目