题目内容
12.向盛有少量氢氧化铜的试管中加入适量盐酸,充分反应后,再加入过量铁粉,反应完成后过滤,滤渣中含有的物质是( )| A. | 铜粉 | B. | 铁粉 | C. | 铜粉和铁粉 | D. | 氢氧化铜和铁粉 |
分析 氢氧化铜能与足量盐酸反应生成氯化铜和水,铁与盐酸反应生成氯化亚铁和氢气,与氯化铜反应生成铜和氯化亚铁,据此判断.
解答 解:氢氧化铜能与足量盐酸反应生成氯化铜和水,氢氧化铜完全反应,铁的性质活泼,能够与氯化铜、盐酸反应,若铁足量则反应后剩余滤渣中含有铜、过量的铁,
故选:C.
点评 本题考查了元素化合物知识,掌握酸的化学性质、金属的化学性质,熟悉铁、铜、氢气的活泼性是解题关键,题目难度不大.

练习册系列答案
相关题目
2.下列关于有机物的说法正确的是( )
| A. | 用溴的四氯化碳溶液可鉴别CH4和C2H4 | |
| B. | “西气东输”中的“气”指的是煤气 | |
| C. | 乙烯、聚乙烯分子中均含有碳碳双键,均可使酸性KMnO4溶液褪色 | |
| D. | 石油裂化主要得到乙烯 |
3.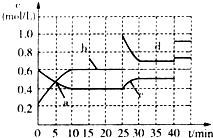 已知某可逆反应:2M(g)?N(g)△H<0.现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示.下列说法中,正确的是( )
已知某可逆反应:2M(g)?N(g)△H<0.现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示.下列说法中,正确的是( )
 已知某可逆反应:2M(g)?N(g)△H<0.现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示.下列说法中,正确的是( )
已知某可逆反应:2M(g)?N(g)△H<0.现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示.下列说法中,正确的是( )| A. | a、b、c、d四个点中处于平衡状态的点是a、b | |
| B. | 反应进行至25 min时,曲线发生变化的原因是加入了0.4 mol N | |
| C. | 若调节温度使35 min时体系内N的体积分数与15 min时相等,应升高温度 | |
| D. | 若在40 min时出现如图所示变化,则可能是因为加入催化剂引起的 |
20.H-H、Cl-Cl和H-Cl的键能分别为436KJ/mol、243KJ/mol和431KJ/mol(键能是指破坏或形成1mol化学键所吸收或放出的能量),请用此数据估计,由Cl2、H2生成2molHCl时的热效应为( )
| A. | 吸热91.5KJ | B. | 放热183KJ | C. | 吸热183KJ | D. | 放热91.5KJ |
7.以下叙述正确的是( )
| A. | 由同种元素组成的纯净物叫单质 | |
| B. | 由两种或两种以上的元素组成的物质叫混合物 | |
| C. | 石油是一种纯净物 | |
| D. | 合金都是化合物 |
1.下列物质暴露在空气中不易变质的是( )
| A. | 氯化钠 | B. | 氢氧化钠 | C. | 溴化银 | D. | 漂白粉 |