题目内容
尾气SO2用NaOH溶液吸收后会生成Na2SO3.现有常温下0.1mol/L Na2SO3溶液,实验测定其pH约为8,完成下列问题:(1)该溶液中c(Na+)与 c(OH-)之比为
(2)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是
A.Na2SO3 B.Ba(NO3)2 C.Na2S D.酸性KMnO4.
②依据溶液中质子守恒分析书写离子浓度关系;
(2)依据选项中的溶液性质和二氧化硫反应的过程和化学方程式定量关系分析计算.
①该溶液中c(Na+)=0.2mol/L,c(OH-)=
| 10-14 |
| 10-8 |
②常温下0.1mol/L Na2SO3溶液,该溶液中存在质子守恒,c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3),故答案为:c(HSO3-)+2c(H2SO3);
(4)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,
A.Na2CO3 吸收二氧化硫发生的反应为:Na2CO3+2SO2+H2O=2NaHSO3+CO2↑,1molNa2CO3 最多吸收二氧化硫2mol;
B.Ba(NO3)2 吸收二氧化硫反应化学方程式为Ba(NO3)2+3SO2+2H2O=BaSO4↓+2H2SO4+2NO↑:1molBa(NO3)2最多吸收二氧化硫3mol;
C.Na2S 吸收二氧化硫发生的反应为:2Na2S+5SO2+2H2O=4NaHSO3+3S↓,1mol2Na2S最多反应二氧化硫2.5mol;
D.酸性KMnO4溶液吸收二氧化硫的反应2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,1molKMnO4最多反应二氧化硫2.5mol;
计算分析吸收二氧化硫理论吸收量由多到少的顺序是B>C=D>A,
故答案为:B>C=D>A.

 阅读快车系列答案
阅读快车系列答案| A、SO2通入紫色的石蕊中先变红后褪色 | B、不能使澄清的石灰水变浑浊 | C、SO2能漂白某些物质,说明其具有氧化性 | D、用NaOH溶液处理含有SO2的尾气 |
工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
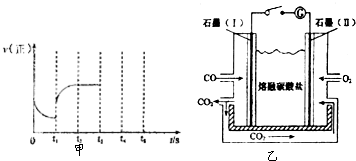
(1)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,则下列说法正确的是???????????? 。
A.若反应速率v(SO2)=v(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.保持温度和容器体积不变,平衡后再充入2molSO3,再次平衡时各组分浓度均比原平衡时的浓度大
F.平衡后升高温度,平衡常数K增大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | |||
1 | T1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | 4 | 2 | 0.4 | y | 9 |
①实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为????? ,表中y=???? 。
②T1?? ??? T2 ,(选填“>”、“<”或“=”),实验2中达平衡时 O2的转化率为??????? 。
(3)尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1mol/LNa2SO3溶液,实验测定其pH约为8,完成下列问题:
①该溶液中c(Na+)与 c(OH-) 之比为?????????? 。
②该溶液中c(OH-) = c(H+)+ ??????? + ??????? (用溶液中所含微粒的浓度表示)。
③当向该溶液中加入少量NaOH固体时,c(SO32-)???? ,c(Na+)???? 。(选填“增大”、“减小”或“不变”)
(4)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是 ??????????? 。
A.Na2CO3?? ???? B.Ba(NO3)2 ??? C.Na2S??? D.酸性KMnO4
工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1mol O2发生反应,则下列说法正确的是??????????????????? 。
A.若反应速率v (SO2) ﹦v (SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.平衡后升高温度,平衡常数K增大
F.保持温度和容器体积不变,平衡后再充入2molSO3,再次平衡时各组分浓度均比原平衡时的浓度大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | |||
1 | T1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | 4 | 2 | 0.4 | y | 9 |
①实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为??????? ,? 表中y? ﹦?????? 。
②T1????????????????? T2 ,(选填“>”、“<”或“=”), 实验2中达平衡时 O2的转化率为???????????????? 。
(3)尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1 mol/L Na2SO3溶液,实验测定其pH约为8,完成下列问题:
① 该溶液中c(Na+)与 c(OH-) 之比为???????????????????????????????????????? 。
② 该溶液中c(OH-) = c(H+)+ ???????????? + ????????????? (用溶液中所含微粒的浓度表示)。
③ 当向该溶液中加入少量NaOH固体时,c(SO32-)???????????????? , 水的离子积Kw? ??? ??????????????? 。(选填“增大”、“减小”或“不变”)
(4)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是 ????????????????????????????????????????????? 。
A. Na2CO3???????? ?? B. Ba(NO3)2 ??????????? C.Na2S???????? D.酸性KMnO4