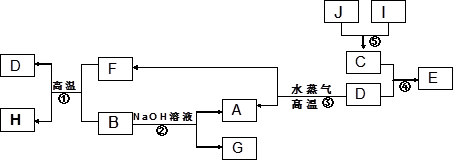题目内容
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列
问题:
(1)④、⑤、⑦的原子半径由大到小的顺序为 (用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 > 。
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。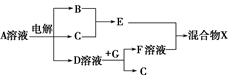
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法: 。
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有 。
(1)Na>Cl>F
(2)HClO4 H2SO4
(3)H2O2+2Fe2++2H+=2Fe3++2H2O
(4)①2Al+2NaOH+2H2O=2NaAlO2+3H2↑
②取少量A溶液滴加几滴(稀硝酸酸化的)硝酸银溶液有白色沉淀生成
③0.01
④Al(OH)3、H2O、NaCl
解析

 新课标阶梯阅读训练系列答案
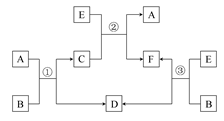
新课标阶梯阅读训练系列答案已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系如图所示。则甲和X不可能是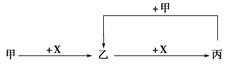
| A.甲为C,X为O2 |
| B.甲为SO2,X为NaOH溶液 |
| C.甲为Fe,X为Cl2 |
| D.甲为AlCl3溶液,X为NaOH溶液 |
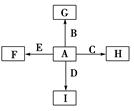
甲、乙、丙、丁、戊是中学化学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。下列说法不正确的是
( )。
| A.若组成甲、乙的元素位于同一周期,则戊可能是一种弱酸 |
| B.若组成甲、乙的元素位于同一主族,则戊可能是一种弱酸 |
| C.若甲为短周期中原子半径最大的主族元素形成的单质,且戊为碱,则丙只能为Na2O2 |
| D.若丙、丁混合生成白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用 |