题目内容
【题目】电解质溶液的电导率越大,导电能力越强。用0.100mol·L-1的NaOH溶液分别滴定10.00mL 浓度均为0.100mol·L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液电导率如图所示。下列说法不正确的是( )
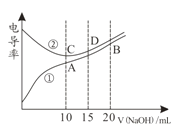
A.曲线①代表滴定CH3COOH溶液的曲线
B.在相同温度下,A、B、C 三点溶液中水电离的 c(H+):B<A=C
C.D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
D.A点溶液中:c(CH3COO-)+c(OH-)-c(H+) = 0.05mol·L-1
【答案】B
【解析】
试题分析:溶液导电能力与离子浓度成正比,CH3COOH是弱电解质,溶液中离子浓度较小,加入KOH后,溶液中离子浓度增大,溶液导电性增强;HCl是强电解质,随着KOH溶液加入,溶液体积增大,导致溶液中离子浓度减小,溶液导电能力减弱,当完全反应式离子浓度最小,继续加入KOH溶液,离子浓度增大,溶液导电能力增强,根据图知,曲线②代表0.1 mol/L NaOH溶液滴定HC1溶液的滴定曲线,曲线①代表0.1 mol/LKOH溶液滴定CH3COOH溶液的滴定曲线;A.由分析可知,曲线①代表滴定CH3COOH溶液的曲线,故A正确;B.酸或碱抑制水电离,含有弱离子的盐促进水电离,C点溶质为NaCl,A点溶质为醋酸钠,促进水电离,B点为等物质的量浓度的醋酸钠和NaOH,NaOH会抑制水的电离,所以在相同温度下,水电离的c(H+):B<C<A,故B错误;C.D点溶液中,c(Na+)=1.5c(Cl-),溶液中电荷守恒为c(Cl-)+c(OH-)=c(Na+)+c(H+),则c(Cl-)=2c(OH-)-2c(H+),故C正确;D.A点溶液中c(Na+)=0.05mol/L,电解质溶液中都存在电荷守恒,根据电荷守恒得c(CH3COO-)+c(OH-)-c(H+)=c(Na+)=0.05mol/L,故D正确;故选B。

 阅读快车系列答案
阅读快车系列答案