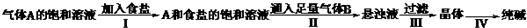题目内容
我国化学家侯德榜根据NaHCO3的溶解度比NaCl、Na2CO3、NH4Cl都小的性质,运用NaCl+CO2+NH3+H2O根据侯德榜制碱法原理,实验室用食盐、氨水、大理石、盐酸制取碳酸钠。其实验过程如下:①配制含氨的氯化钠饱和溶液;②用石灰石和稀盐酸制取纯净的CO2;③将CO2通入NaCl的氨溶液中,得到碳酸氢钠晶体;④过滤,冷水洗涤沉淀;⑤焙烧NaHCO3得到Na2CO3。
试回答下列问题:
(1)某学生将实验步骤①②③设计成下图所示的装置:

洗气瓶B中的液体是_________,烧杯C中的液体是_________。装置A中的离子方程式是____________________________________。
(2)实验步骤④中过滤操作要求做到“一贴、二低、三靠”,其具体含义是:
一贴:_____________________________________________;
二低:_____________________________________________;
三靠:_____________________________________________。
洗涤沉淀的目的是___________________________________________________________。
(3)该学生设计下图所示装置进行NaHCO3的分解,并证实产物中有CO2产生。

①试管中发生的化学反应方程式是:____________________________________。
②指出该学生设计的装置图的错误之处,并改正(文字说明即可)。
③停止加热时应该怎样操作,为什么?
④烧杯中发生反应的离子方程式是:____________________________________。
解析:考查信息分析与处理能力,以及实验的基本操作能力。
答案:(1)饱和NaHCO3溶液(水或NaHCO3也正确)NaCl的氨溶液CaCO3+2H+====Ca2++CO2↑+H2O
(2)滤纸紧贴漏斗内壁滤纸边缘低于漏斗边缘液面低于滤纸边缘烧杯靠玻璃棒玻璃棒靠三层滤纸,漏斗口靠烧杯洗去晶体吸附的杂质
(3)①2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
②试管内导管太长,伸出活塞即可;试管口略向上倾斜,试管口应略向下倾斜。
③先撤除导管,再熄灭酒精灯,否则易使烧杯中的液体倒吸进入热试管而使其破裂。
④Ca2++2OH-+CO2====CaCO3↓+H2O

气体A的饱和溶液
| 加入食盐 |
| Ⅰ |
| 通入足量气体B |
| Ⅱ |
| 过滤 |
| Ⅲ |
| Ⅳ |
则下列叙述错误的是( )
| A、A气体是CO2,B气体是NH3 |
| B、第Ⅲ步得到的晶体是发酵粉的主要成分 |
| C、第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 |
| D、第Ⅳ步操作的主要过程有溶解、蒸发、结晶 |