题目内容
设NA为阿伏加德罗常数的值,下列说法中正确的是 ( )
| A.30g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA |
| B.1mol Cl2与足量的NaOH溶液反应,转移的电子数为2NA |
| C.100mL0.2mol·L-1的AlCl3溶液中,含Al3+数为0.02NA |
| D.标准状况下,将22.4L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA |
A
解析试题分析:甲醛分子式是CH2O, 醋酸分子式是C2H4O2.最简式CH2O。它们的分子式都符合(CH2O)n. 最简式CH2O的式量是30,所以30g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA。正确。B.Cl2+2NaOH="NaCl+NaClO." 1mol Cl2与足量的NaOH溶液反应,转移的电子数为NA.错误。C .AlCl3是强酸弱碱盐,铝离子水解使Al3+数少于0.02NA。错误。D. 氯化氢溶于足量水中产生盐酸。盐酸是强酸,在水中完全电离,所以溶液中不含有的HCl分子。错误。
考点:考查阿伏加德罗常数在物质或反应中的有关计算的知识。

练习册系列答案
相关题目
同温同压下有两份体积相同的CO2和O3,关于它们的叙述正确的是( )
| A.分子数之比是1:1 | B.原子个数比是3:2 |
| C.质子数比是 12:11 | D.密度之比是1:1 |
NA表示阿伏加德罗常数.下列说法中正确的是( )
| A.Cu和足量的稀硝酸反应产生4.48L气体时,转移的电子数为0.6NA |
| B.1.2g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA |
| C.标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为2NA |
| D.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA |
已知阿伏加德罗常数、物质的摩尔质量及1摩尔物质的体积,下列物理量中尚不能全部计算出其近似值的是( )
| A.气体物质分子的大小和质量 | B.液态物质分子的大小及质量 |
| C.固体物质分子的大小和质量 | D.气体物质分子的质量 |
在t℃时,将a gNH3完全溶于水,得到VmL溶液,假设该溶液的密度为ρg/cm3,质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中正确的是( )
| A.溶质的质量分数w=(1000a/17V)100% |
| B.溶质的物质的量浓度c=1000a/17V (mol/L) |
| C.溶液中c(OH-)=b/V (mol/L) |
| D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w |
用NA表示阿伏加德罗常数,下列关于0.2 mol·L-1K2SO4溶液的正确说法是 ( )
| A.1 L溶液中K+浓度是0.4 mol·L-1 |
| B.溶液中含有0.4NA个K+ |
| C.1 L溶液中所含K+、SO42-总数为0.3NA |
| D.2 L溶液中SO42-浓度是0.4 mol·L-1 |
下列说法不正确的是( )
| A.5.85gNaCl晶体溶于100g水,所得溶液物质的量浓度不等于1mol/L |
| B.20g浓度为c mol·L-1的氨水中加入一定量的水稀释成0.5cmol·L-1,则加入水的体积小于20ml |
| C.某氯化镁溶液的密度为1.18 g·cm-3,其中镁离子的质量分数为5.1%,300 mL该溶液中Cl-的物质的量约等于1.50 mol |
D.V L Fe2(SO4)3溶液中含Fe3+m g,则溶液中SO42-的物质的量浓度为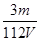 mol·L-1 mol·L-1 |