题目内容
已知下列变化中,0.2 mol x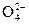 参加反应时共转移0.4 mol电子,
参加反应时共转移0.4 mol电子,
Rx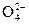 +
+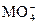 + H+——RO2+ Mn2++H2O
+ H+——RO2+ Mn2++H2O
(1)求x的值。
(2)求参加反应的H+的物质的量。
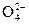 参加反应时共转移0.4 mol电子,
参加反应时共转移0.4 mol电子,Rx
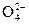 +
+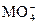 + H+——RO2+ Mn2++H2O
+ H+——RO2+ Mn2++H2O(1)求x的值。
(2)求参加反应的H+的物质的量。
(1)2 (2)0.64 mol



 O2
O21 mol Rx
 转化为RO2失去电子的物质的量为:(4-
转化为RO2失去电子的物质的量为:(4- )x,即(4x-6) mol
)x,即(4x-6) mol所以(4x-6)×0.2 mol="0.4" mol,解得:x=2。
配平后的该反应方程式为:
5R2
 +2Mn
+2Mn +16H+====10RO2+2Mn2++8H2O
+16H+====10RO2+2Mn2++8H2O参加反应的H+为:n(H+)=
 ·n(R2
·n(R2 )=
)= ×0.2 mol="0.64" mol
×0.2 mol="0.64" mol
练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
 可溶于水,并发生如下反应:Cl
可溶于水,并发生如下反应:Cl HCl+HClO。对此,下列说法错误的是( )
HCl+HClO。对此,下列说法错误的是( ) 2X-+2W3+
2X-+2W3+ A.(CN)2+2NaOH===NaCN+NaCNO+H2O
A.(CN)2+2NaOH===NaCN+NaCNO+H2O