��Ŀ����
����Ŀ����Ҫ�����
��1����Ȼ������Ҫ�ɷ���_____��д��ѧʽ��������ӿռ乹����_____��
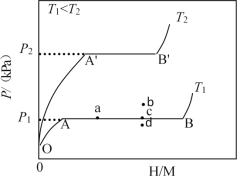
��2������Һ��������Ϊ����ʱ������Ӧ�Ļ�ѧ����ʽ_____����Ӧ����Ϊ_____��
��3��д��Na��ˮ��Ӧ�����ӷ���ʽ_____��
��4��CH2��CH��CH��CH2��H2��һ�������·���1��4���ӳɷ�Ӧ�Ļ�ѧ����ʽ_____��
��5�����Ľṹ��ʽ��![]() �������ʽ_____��һ�ȴ�����_____�֡�
�������ʽ_____��һ�ȴ�����_____�֡�
��6��ijĦ������Ϊ42gmol��1������A��ʹ��ˮ��ɫ��A�Ľṹ��ʽΪ_____��A��һ�������¿��Է����Ӿ۷�Ӧ������Ľṹ��ʽΪ_____��
���𰸡�CH4 ����������  ȡ����Ӧ 2Na+2H2O��2Na++2OH��+H2 CH2��CH��CH��CH2+H2
ȡ����Ӧ 2Na+2H2O��2Na++2OH��+H2 CH2��CH��CH��CH2+H2![]() CH3��CH��CH��CH3 C10H8 2 CH2��CH��CH3
CH3��CH��CH��CH3 C10H8 2 CH2��CH��CH3 ![]()
��������
��1����Ȼ������Ҫ�ɷ�Ϊ���飬Ϊ��������ṹ���ʴ�Ϊ��CH4�����������ͣ�
��2������Һ��������Ϊ����ʱ����ȡ����Ӧ�����屽������ʽΪ ��
��
�ʴ�Ϊ�� ��ȡ����Ӧ��
��ȡ����Ӧ��
��3���ƺ�ˮ��Ӧ�����������ƺ���������Ӧ�����ӷ���ʽΪ2Na+2H2O��2Na++2OH��+H2���ʴ�Ϊ��2Na+2H2O��2Na++2OH��+H2��
��4��CH2��CH��CH��CH2��H2��һ�������·���1��4���ӳɷ�Ӧ����CH3��CH��CH��CH3����Ӧ�ķ���ʽΪCH2��CH��CH��CH2+H2һ������CH3��CH��CH��CH3���ʴ�Ϊ��CH2��CH��CH��CH2+H2![]() CH3��CH��CH��CH3��
CH3��CH��CH��CH3��
��5��![]() �����к���10��C��8��Hԭ�ӣ�����ʽΪC10H8����������2��H����һ�ȴ�����2�֣�
�����к���10��C��8��Hԭ�ӣ�����ʽΪC10H8����������2��H����һ�ȴ�����2�֣�
�ʴ�Ϊ��C10H8 ��2��
��6��Ħ������Ϊ42gmol��1������A��ʹ��ˮ��ɫ������̼̼˫����ӦΪCH2��CH��CH3���ɷ����Ӿ۷�Ӧ���ɾ۱�ϩ������ʽΪCH2��CH��CH3![]()
![]() ���ʴ�Ϊ��CH2��CH��CH3 ��
���ʴ�Ϊ��CH2��CH��CH3 ��![]() ��
��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�