题目内容
常温下,向20mL硫酸和盐酸混合溶液中加入0.05mol/L的Ba(OH)2溶液时,生成BaSO4沉淀量及溶液pH发生如图所示的变化.(1)开始时混合溶液中硫酸和盐酸的物质的量浓度各是多少?
(2)在A点溶液的pH是多少?
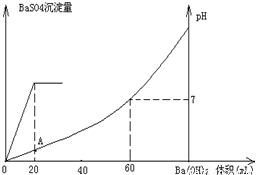
【答案】分析:(1)由图可知,加入20mLBa(OH)2溶液时,硫酸钡沉淀达最大值,故根据方程式计算硫酸的物质的量;
由图可知,PH=7时,消耗60mLBa(OH)2溶液,由H++OH-═H2O可知n(H+)=n(OH-),据此计算原溶液中含有的n(H+),继而计算HCl电离产生的氢离子物质的量,再根据c=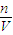 计算硫酸、盐酸的物质的量浓度;
计算硫酸、盐酸的物质的量浓度;
(2)A点时硫酸反应,而盐酸未反应,计算混合后氢离子的浓度,根据pH=-lgc(H+).
解答:解:由图可知,0~20mLBa(OH)2溶液发生H2SO4+Ba(OH)2═BaSO4↓+H2O,20mL~60mLBa(OH)2溶液发生发生H++OH-═H2O,
(1)由图可知,加入20mLBa(OH)2溶液时,硫酸钡沉淀达最大值,设硫酸的物质的量为x,则:
H2SO4+Ba(OH)2═BaSO4↓+H2O
1 1
x 0.02L×0.05mol?L-1
故x=0.02L×0.05mol?L-1=0.001mol,
硫酸的物质的量浓度为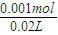 =0.05mol?L-1,
=0.05mol?L-1,
由图可知,PH=7时,消耗60mLBa(OH)2溶液,由H++OH-═H2O可知原溶液中含有的n(H+)=n(OH-)=0.06L×0.05mol?L-1=0.003mol,故n(HCl)=0.003mol×2-0.001mol×2=0.004mol,
故原溶液中HCl的物质的量浓度=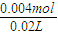 =0.2mol/L
=0.2mol/L
答:原混合液中硫酸的物质的量浓度为0.05mol?L-1,盐酸的物质的量浓度为0.2mol?L-1;
(2)由图可知,A点硫酸完全反应,氢离子的浓度为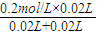 =0.1mol/L,则pH=-lg0.1=1,
=0.1mol/L,则pH=-lg0.1=1,
答:A点溶液的pH为1.
点评:本题考查学生利用化学反应方程式的计算,明确图象中对应的化学反应是解答本题的关键,学生应学会图象的分析来解答.
由图可知,PH=7时,消耗60mLBa(OH)2溶液,由H++OH-═H2O可知n(H+)=n(OH-),据此计算原溶液中含有的n(H+),继而计算HCl电离产生的氢离子物质的量,再根据c=
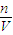 计算硫酸、盐酸的物质的量浓度;
计算硫酸、盐酸的物质的量浓度;(2)A点时硫酸反应,而盐酸未反应,计算混合后氢离子的浓度,根据pH=-lgc(H+).
解答:解:由图可知,0~20mLBa(OH)2溶液发生H2SO4+Ba(OH)2═BaSO4↓+H2O,20mL~60mLBa(OH)2溶液发生发生H++OH-═H2O,
(1)由图可知,加入20mLBa(OH)2溶液时,硫酸钡沉淀达最大值,设硫酸的物质的量为x,则:
H2SO4+Ba(OH)2═BaSO4↓+H2O
1 1
x 0.02L×0.05mol?L-1
故x=0.02L×0.05mol?L-1=0.001mol,
硫酸的物质的量浓度为
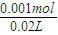 =0.05mol?L-1,
=0.05mol?L-1,由图可知,PH=7时,消耗60mLBa(OH)2溶液,由H++OH-═H2O可知原溶液中含有的n(H+)=n(OH-)=0.06L×0.05mol?L-1=0.003mol,故n(HCl)=0.003mol×2-0.001mol×2=0.004mol,
故原溶液中HCl的物质的量浓度=
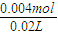 =0.2mol/L
=0.2mol/L答:原混合液中硫酸的物质的量浓度为0.05mol?L-1,盐酸的物质的量浓度为0.2mol?L-1;
(2)由图可知,A点硫酸完全反应,氢离子的浓度为
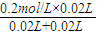 =0.1mol/L,则pH=-lg0.1=1,
=0.1mol/L,则pH=-lg0.1=1,答:A点溶液的pH为1.
点评:本题考查学生利用化学反应方程式的计算,明确图象中对应的化学反应是解答本题的关键,学生应学会图象的分析来解答.

练习册系列答案
相关题目