题目内容
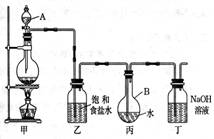
(共9分)现用如图所示的装置制取较多量的饱和氯水并测定饱和氯水的pH。回答有关问题:
(共9分)
(1) 装置甲 MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
装置乙 2NaOH+Cl2=NaCl+NaClO+H2O
(2)丙中的导管有气泡溢出水面,且液面上方充满黄绿色气体 。
(3) Cl2 ,装置乙的作用 除去氯气中的氯化氢气体 。
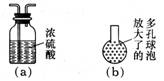
(4)①你认为有无必要? 无 。
②多孔球泡,这样做的好处是: 增加氯气与水的接触面积,利于氯气溶解。
③这样做对实验结果的影响是: 使测定的pH减小
解析(1)装置甲,为实验室制氯气,所以方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O;装置丁,为氯气的尾气处理,所以方程式为:2NaOH+Cl2=NaCl+NaClO+H2O。
MnCl2+Cl2↑+2H2O;装置丁,为氯气的尾气处理,所以方程式为:2NaOH+Cl2=NaCl+NaClO+H2O。
(2)当丙中的导管有气泡溢出水面,且液面上方充满黄绿色气体,证明氯水已饱和。
(3)制取结束时,装置丙的液体为氯水,氯水中含有最多的微粒,除水分子外是Cl2 ;
装置乙的作用是除去氯气中的氯化氢气体。
(4)①在装置乙和丙之间增加如图(a)所示的装置,后面制取氯水,不需干燥。②在装置丙的长导管下口处,接如图(b)所示的多孔球泡,这样做的好处是增加氯气与水的接触面积,利于氯气溶解。③若撤去装置乙,直接将装置甲和丙相连。这样做对实验结果的影响是使测定的pH减小。
点评:考查实验室制取氯气,和氯水的制备。

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目