题目内容
【题目】室温下,用相同浓度的NaOH溶液,分别滴定相同体积、浓度均为0.l mol·L-1的三种弱酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是( )

A.室温下,同浓度的NaA、NaB、NaD溶液的pH大小关系: pH(NaA)>pH(NaB)>pH(NaD)
B.滴定至P点时,溶液中:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)>c(B-)>c(D-)
D.当恰好中和时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-2c(H+)
【答案】C
【解析】
0.1mol/LHA、HB、HD溶液的pH都大于1,说明HA、HB、HD都为弱酸;浓度相同的酸溶液,pH越小酸性越强,由图像可知酸性HA>HB>HD。
A.由分析可知酸性HA>HB>HD,酸性越强其电离平衡常数越大,含其酸根阴离子的盐水解平衡常数越小,水解后碱性越弱,故同浓度的NaA、NaB、NaD溶液的pH大小关系: pH(NaA)<pH(NaB)<pH(NaD),A项错误;
B.P点中和50%,溶液中溶质为等物质的量浓度的酸(HB)和盐(NaB),由图可知溶液呈酸性,则c(H+)>c(OH-),且酸的电离程度大于酸根离子水解程度,
①NaB完全电离:![]() ,这一步的c(B-)=c(Na+),
,这一步的c(B-)=c(Na+),
②HB少部分电离:![]() ,则c(HB)>c(H+),
,则c(HB)>c(H+),
③NaB少部分水解 ![]() ,由于酸的电离程度大于盐的水解程度,则HB电离产生的B-相对NaB水解消耗的B-多,所以c(B-)>c(Na+),由于HB电离消耗得多,水解生成的HB少,所以c(Na+)>c(HB),则c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),故B错误;
,由于酸的电离程度大于盐的水解程度,则HB电离产生的B-相对NaB水解消耗的B-多,所以c(B-)>c(Na+),由于HB电离消耗得多,水解生成的HB少,所以c(Na+)>c(HB),则c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),故B错误;
C.当pH=7时,根据电荷守恒三种溶液中离子浓度关系为:
c(Na+)+c(H+)=c(A-)+c(OH-),由于c(H+)=c(OH-),所以c(Na+)=c(A-),
c(Na+)+c(H+)=c(B-)+c(OH-),由于c(H+)=c(OH-),所以c(Na+)=c(B-),
c(Na+)+c(H+)=c(D-)+c(OH-),由于c(H+)=c(OH-),所以c(Na+)=c(D-),
同浓度、同体积的酸溶液加NaOH溶液至显中性,酸越强消耗的碱越多,酸性HA>HB>HD,故消耗的NaOH:HA>HB>HD,所以中性溶液中c(Na+)(HA)>c(Na+)(HB)>c(Na+)(HD),故c(A-)>c(B-)>c(D-),C项正确;
D. 恰好中和时,三种溶液所消耗的氢氧化钠体积相同,生成三种盐的浓度相同,混合后溶液因盐的水解溶液呈碱性,质子守恒的关系为:c(OH-)=c(HA)+c(HB)+c(HD)+c(H+),故D项错误。
故答案为C。

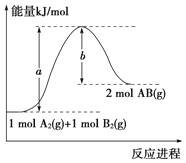
【题目】氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)![]() 2NH3(g)+3/2O2(g) △H= a kJ mol-1。
2NH3(g)+3/2O2(g) △H= a kJ mol-1。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
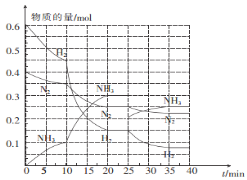
①0~10 min内,以NH3表示的平均反应速率为_________。
②在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 20 min达到第一次平衡,在反应进行至25 min时,曲线发生变化的原因是____________,35min达到第二次平衡,则平衡的平衡常数K1______K2(填“>”“<”或“ = ”)
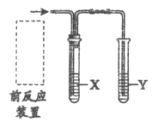
【题目】实验室用下图装置完成表中的四个实验,不能达到实验目的的是
实验装置 | 实验目的 | 试剂X | 试剂Y | |
| A. | 检验C2H5Br消去反应后的气体产物 | 水 | 酸性KMnO4溶液 |
B. | 检验C2H5OH消去反应后的气体产物 | NaOH溶液 | Br2的CCl4溶液 | |
C. | 比较醋酸、碳酸、苯酚酸性强弱 | NaOH溶液 | 苯酚钠溶液 | |
D. | 检验制取乙炔时的气体产物 | CuSO4溶液 | 酸性KMnO4溶液 |
A. AB. BC. CD. D
【题目】第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。继续失去第二个电子所需能量称第二电离能。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。回答下列问题:
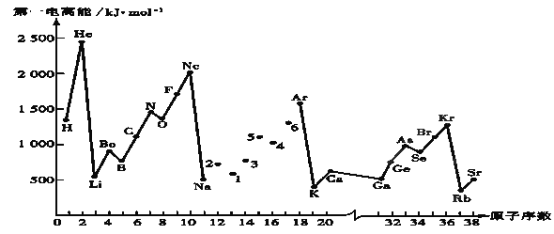
(1)同一周期元素的第一电离能从左到右总趋势是___(填增大、减小或不变,下同);同一主族元素原子从上到下的第一电离能I1变化规律是______________;稀有气体的第一电离能在同周期中是最大的,原因是______________________________________________________________________。
(2)认真分析上图中同周期元素第一电离能的变化规律,发现有一些反常,第一电离能 IIA>IIIA,VA>VIA: 如I1(铍)>I1(硼),2号大于1号,I1(氮)>I1(氧),5号大于4号。可能原因是____。(3)已知2号的I1=738KJ/mol, 则它的I2___738KJ/mol, I3___3×738KJ/mol;(填>、<、=)(4)已知5号和6号元素的电负性分别为2.1和3.0,则4号元素的电负性可能为(___)
A.3.5 | B.1.8 | C.2.5 | D.4.0 |
(5)上图中4、5、6三种元素最高价含氧酸的酸性从强到弱顺序为____________(用对应酸的化学式表示);它们的气态氢化物的稳定性均比同主族上一周期的元素气态氢化物弱,原因是:_________。
【题目】将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示)。
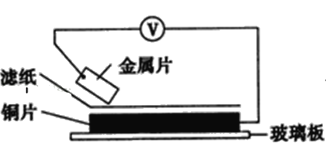
在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大)依据记录数据判断,下列结论中正确的是( )
金属 | 电子流动方向 | 电压(V) |
甲 | 甲→Cu | +0.78 |
乙 | Cu→乙 | -0.15 |
丙 | 丙→Cu | +1.35 |
丁 | 丁→Cu | +0.30 |
A.金属乙能从硫酸铜溶液中置换出铜
B.甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀
C.在四种金属中乙的还原性最强
D.甲、丁若形成原电池时,甲为正极