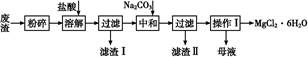
题目内容
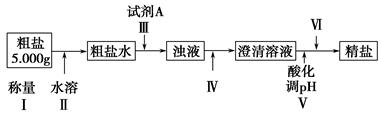
海水是巨大的资源宝库,工业上从海水中提取食盐和溴的过程如下:
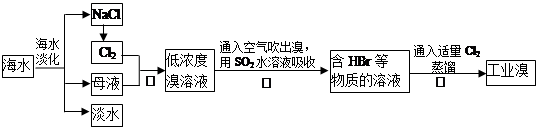
(1)可以用淀粉-KI试纸检验操作I中是否有溴生成,其操作方法是___________________。
(2)操作Ⅱ发生反应的离子方程式为_____________;可以用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,生成物中溴的化合价分别为+5和-1价,操作Ⅲ中如果用稀硫酸代替氯气,则操作Ⅲ中发生反应的离子方程式为______。
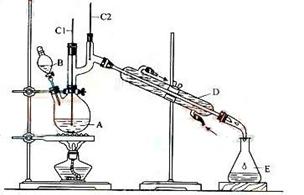
(3)溴苯是一种化工原料,可以用溴和苯反应合成。实验室合成溴苯的装置示意图如下:
下表为苯、溴和溴苯的相关数据:
回答下列问题:
(4)在A中加入30 .0mL无水苯和少量铁屑。在B中小心加入8.0 mL液态溴。向A中滴加液溴,反应一段时间后,点燃酒精灯加热蒸馏。
①在该实验中, B装置的名称是__________,A的容积最适合的是_________(填编号)
a.25mL b.50mL c.100mL d.250mL
②收集溴苯时,应根据_________(填“C1”或“C2”)所显示的温度,其温度应为_________。
③在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,用它可承接的物质有_______________________(填化学式)。
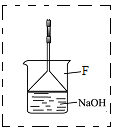
④某化学小组设计如下实验方案,证明苯和溴发生的是取代反应而不是加成反应。
第一步:取少量反应后F装置中的溶液于试管中;第二步:向其中加入过量的稀硝酸;第三步:继续滴加少量的硝酸银溶液。如果有浅黄色沉淀生成则证明苯和溴发生的是取代反应。
该实验方案__________(填“合理”或“不合理”),理由是__________________。

(1)可以用淀粉-KI试纸检验操作I中是否有溴生成,其操作方法是___________________。
(2)操作Ⅱ发生反应的离子方程式为_____________;可以用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,生成物中溴的化合价分别为+5和-1价,操作Ⅲ中如果用稀硫酸代替氯气,则操作Ⅲ中发生反应的离子方程式为______。
(3)溴苯是一种化工原料,可以用溴和苯反应合成。实验室合成溴苯的装置示意图如下:


下表为苯、溴和溴苯的相关数据:
| | 苯 | 溴 | 溴苯 |
| 密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
回答下列问题:
(4)在A中加入30 .0mL无水苯和少量铁屑。在B中小心加入8.0 mL液态溴。向A中滴加液溴,反应一段时间后,点燃酒精灯加热蒸馏。
①在该实验中, B装置的名称是__________,A的容积最适合的是_________(填编号)
a.25mL b.50mL c.100mL d.250mL
②收集溴苯时,应根据_________(填“C1”或“C2”)所显示的温度,其温度应为_________。
③在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,用它可承接的物质有_______________________(填化学式)。
④某化学小组设计如下实验方案,证明苯和溴发生的是取代反应而不是加成反应。
第一步:取少量反应后F装置中的溶液于试管中;第二步:向其中加入过量的稀硝酸;第三步:继续滴加少量的硝酸银溶液。如果有浅黄色沉淀生成则证明苯和溴发生的是取代反应。
该实验方案__________(填“合理”或“不合理”),理由是__________________。
(1)取一小块淀粉-KI试纸于玻璃片上,用玻璃棒蘸取待测液滴在试纸上,如果试纸变蓝,说明有溴生成,如果不变蓝,说明没有溴生成(2分,操作过程1分,结论1分。)
(2)SO2+Br2+2H2O=SO4-+2Br-+4H+; BrO3?+5Br?+6H+=3Br2+3H2O
(4)①分液漏斗(1分);c(不填编号不得分)
②C2,156℃(每空1分)
③溴、溴化氢、苯(3分,每少或错1种扣1分)
④不合理(1分),溴可以和NaOH溶液反应生成溴离子,也能产生浅黄色沉淀,无法确定是否生成溴化氢,即无法确定两者发生的是取代反应(要点一:溴和NaOH反应;要点二:无法确定是否生成溴化氢。少一个要点扣1分。)
(2)SO2+Br2+2H2O=SO4-+2Br-+4H+; BrO3?+5Br?+6H+=3Br2+3H2O
(4)①分液漏斗(1分);c(不填编号不得分)
②C2,156℃(每空1分)
③溴、溴化氢、苯(3分,每少或错1种扣1分)
④不合理(1分),溴可以和NaOH溶液反应生成溴离子,也能产生浅黄色沉淀,无法确定是否生成溴化氢,即无法确定两者发生的是取代反应(要点一:溴和NaOH反应;要点二:无法确定是否生成溴化氢。少一个要点扣1分。)
试题分析:(1)若有溴生成,则能与淀粉-KI反应,Br2与KI置换出的I2能使淀粉变蓝,所以检验方法为:取一小块淀粉-KI试纸于玻璃片上,用玻璃棒蘸取待测液滴在试纸上,如果试纸变蓝,说明有溴生成,如果不变蓝,说明没有溴生成.
(2)操作Ⅱ发生反应Br2与SO2、H2O发生氧化还原反应,生成H2SO4和HBr,离子方程式为:SO2+Br2+2H2O=SO4-+2Br-+4H+;生成物中溴的化合价分别为+5和-1价,分别为NaBrO3、NaBr,操作Ⅲ中在稀硫酸存在的条件下,NaBrO3与NaBr发生氧化还原反应生成Br2,离子方程式为:BrO3?+5Br?+6H+=3Br2+3H2O
(4)①根据实验装置图,仪器B为分液漏斗; 该实验A装置液体体积一般不超过容积的2/3,不少于1/3,本实验所加液体反应物的体积为38.0mL,所以A的容积最适合的,100mL,C项正确。
②因为C1测量的是溶液的温度,C2测量的是蒸汽的温度,收集馏分时应测量蒸汽的温度,所以根据C2显示的温度,溴苯的沸点为156℃,因此C2显示的温度为156℃。
③溴、溴化氢、苯的沸点低于溴苯,所以收集溴苯之前,F装置承接的物质有溴、溴化氢、苯。
④因为溴和苯反应合成溴苯的反应,一般会有Br2剩余,Br2与NaOH反应生成NaBr,也能与AgNO3反应生成浅黄色沉淀,无法确定是否生成了溴化氢,所以该实验方案不合理。

练习册系列答案
相关题目