题目内容
【题目】钴及其化合物可应用与催化剂、电池、颜料与染料等。
(1)CoO是一种油漆添加剂,可通过反应①②制备。
①2Co(s)+O2(g)=2CoO(s) ΔH1=akJ·mol-1
②2CoCO3(s) =CoO(s) + CO2 (g) ΔH2=akJ·mol-1
则反应2Co(s)+O2(g)+2CO2(g)=2CoO3(s) 的ΔH=_________。
(2)某锂电池的电解质可传导Li+,电池反应式为:LiC6+CoO2![]() C6+LiCoO2
C6+LiCoO2
①电池放电时,负极的电极反应式为_________,Li+向______移动(填“正极”或“负极“)。
②一种回收电极中Co元素的方法是:将LiCoO2与H2O2、H2SO4反应生成CoSO4。该反应的化学方程式为___________________。
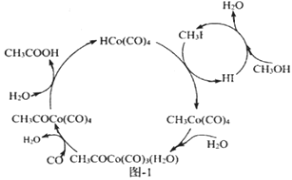
(3)BASF高压法制备醋酸采用钴碘催化循环过程如图-1所示,该循环的总反应方程式为_________________(反应条件无需列出)
(4)某含钴催化剂可同时催化去除柴油车尾气中的碳烟(C)和NOx。不同温度下,将10mol模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图-2所示.
模拟尾气 | 气体 | 碳烟 | ||
NO | O2 | He | ||
物质的量分数或物质的量 | 0.25% | 5% | 94.75% | a mol |
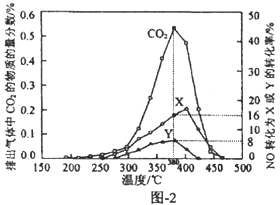
①380℃时,测得排出的气体中含0.45 mol O2和0.0525 mol CO2,则Y的化学式为__________________。
②实验过程中采用NO模拟NOx,,而不采用NO2的原因是______________________。
【答案】 (a-2b)kJ·mol-1 LiC6-e-═Li++C6 正极 2LiCoO2+H2O2+3H2SO4═LiSO4+2CoSO4+4H2O+O2↑ CO+CH3OH→CH3COOH N2O 真实的尾气中的NOx以NO为主(或NO较NO2稳定,NO2气体中存在N2O4,不便于定量测定)
【解析】 (1) ①2Co(s)+O2(g)=2CoO(s) ΔH1=akJ·mol-1,②2CoCO3(s) =CoO(s) + CO2 (g) ΔH2=akJ·mol-1,根据盖斯定律,将①-②×2得:2Co(s)+O2(g)+2CO2(g)=2CoO3(s) ,ΔH= (a-2b)kJ·mol-1,故答案为:(a-2b)kJ·mol-1;
(2)某锂电池的电解质可传导Li+,电池反应式为:LiC6+CoO2![]() C6+LiCoO2
C6+LiCoO2
①电池放电时,负极发生氧化反应,反应的电极反应式为LiC6-e-═Li++C6,原电池中,阳离子向正极移动,Li+向正极移动,故答案为:LiC6-e-═Li++C6;正极;
②将LiCoO2与H2O2、H2SO4反应生成CoSO4,反应的化学方程式为2LiCoO2+H2O2+3H2SO4═LiSO4+2CoSO4+4H2O+O2↑,故答案为:2LiCoO2+H2O2+3H2SO4═LiSO4+2CoSO4+4H2O+O2↑;
.(3)根据图-1所示,该循环的总反应方程式为CO+CH3OH→CH3COOH,故答案为:CO+CH3OH→CH3COOH;
(4)①10mol模拟尾气中含有0.025molNO,0.5mol O2,380℃时,测得排出的气体中含0.45 mol O2和0.0525 mol CO2,因此反应的氧气为0.05mol,根据图像反应的NO为(8%+16%)×0.025mol=0.006mol,根据N守恒,生成的N2或N2O的物质的量分别为0.001mol和0.002mol,设N2O的物质的量为x,根据O原子守恒,0.006mol+0.05mol×2=0.0525 mol×2+x,解得x=0.001mol,因此Y为N2O,故答案为:N2O;
②真实的尾气中的NOx以NO为主,而且NO较NO2稳定,NO2气体中存在N2O4,不便于定量测定,因此实验过程中采用NO模拟NOx,,而不采用NO2,故答案为:真实的尾气中的NOx以NO为主。

 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案