题目内容
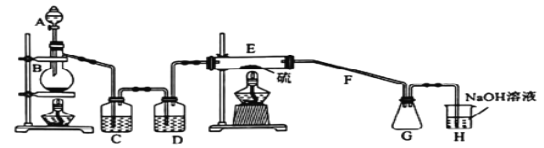
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:

(1)SO2气体还原Fe3+的产物是________________(填离子符号),参加反应的SO2和Fe3+的物质的量之比是________。
(2)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是__________________________________________________。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有________(填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是________,原因是_______________________________________________。
【答案】Fe2+和SO42-1∶2BD吸收多余的二氧化硫,防止污染空气BF方案①SO2也能使酸性高锰酸钾溶液褪色
【解析】
(1)根据反应SO2+2Fe3++2H2O=2 Fe2++SO42-+4H+可知,SO2气体还原Fe3+的产物是Fe2+和SO42-;参加反应的SO2和Fe3+的物质的量之比是:1:2;综上所述,本题答案是:Fe2+和SO42-;1:2。
(2)A、硝酸具有强氧化性,把亚硫酸钠氧化成硫酸钠,得不到二氧化硫,故A错误;
B、浓硫酸虽具有强氧化性,但不能氧化亚硫酸钠,和亚硫酸钠发生复分解反应生成二氧化硫气体,所以B选项是正确;
C、固体硫在纯氧中燃烧,操作不容易控制,故C错误;
D.铜与热浓H2SO4加热反应生成硫酸铜、二氧化硫,可以制备二氧化硫,所以D选项是正确;
综上所述,本题答案是:BD。
(3)二氧化硫是酸性氧化物具有刺激性气味,直接排放污染大气,能和碱反应生成盐和水,所以可用碱液处理二氧化硫,所以装置C的作用是吸收SO2尾气,防止污染空气;因此,本题正确答案是: 吸收多余的二氧化硫,防止污染空气。
(4)操作步骤:蒸发需用到A蒸发皿,E.玻璃棒,冷却结晶需用到烧杯,过滤需用到C.漏斗,D.烧杯,E.玻璃棒,故不需要B.石棉网、F.坩埚;因此,本题正确答案是:BF。
(5)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,所以不合理的是方案①,因为A的溶液中含有SO2, SO2也能使KMnO4溶液褪色;因此,本题正确答案是: 方案①,SO2也能使酸性高锰酸钾溶液褪色。

 阅读快车系列答案
阅读快车系列答案【题目】一氧化氮、二氧化氮等氮氧化物是常见的大气污染物,然而它们在工业上有着广泛的用途。
已知:①室温下,2NO+Na2O2=2NaNO2;②酸性条件下,NO或NO2-都能与MnO4—反应生成NO3-。
Ⅰ.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示:
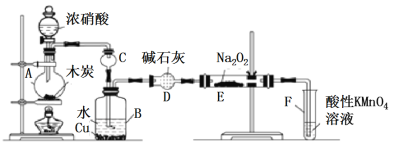
(1)A中反应的化学方程式_____________;
(2)装置B中观察到的主要现象______________;
(3)仪器D的名称是___________________;
(4)A中滴入浓硝酸之前,应先通入N2一段时间,原因是____________;
(5)写出NO被酸性KMnO4氧化的离子反应方程式______________;
(6)若无装置D,则E中产物除NaNO2外,还有_______(填化学式)。
Ⅱ.某研究性学习小组对NO2与Na2O2能否发生反应进行探究。
步骤1:提出假设
假设一:NO2与Na2O2不反应;
假设二:NO2能被Na2O2氧化;
假设三:______________________________________________。
步骤2:设计实验
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设________不成立。
(2)为验证假设二是否成立,该小组同学进行如下定性实验研究,请完成下表内容。
实验步骤(不要求写具体操作过程,试剂、仪器任选) | 预期的实验现象及结论 |
取适量的白色固体置于试管中,加蒸馏水溶解, ①__________________________________________ | ②___________________________ |