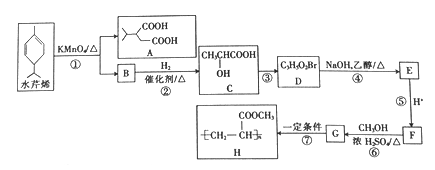
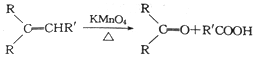
题目内容
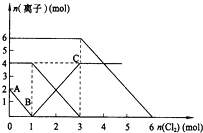
【题目】向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-2Fe3++2I-═2Fe2++I2,则下列有关说法中,不正确的是( )
A. 还原性:I->Fe2+>Br-
B. 当通入2molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl-
C. 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
D. 原混合溶液中FeBr2的物质的量为2mol
【答案】D
【解析】A项,根据氧化还原反应的强弱规律,氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,依据已知的两个反应方程式可知,Fe2+>Br-,I->Fe2+,故还原性是:I->Fe2+>Br-,所以A正确;B项,根据氧化还原反应的先后规律,通入Cl2时,溶液中的离子将按照I-、Fe2+、Br-的顺序先后反应,再结合图像纵坐标可知,I-有2mol、Fe2+有4mol、Br-有6mol,则通入2molCl2时,2mol的I-将消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应方程式为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl-,所以B正确;C项,根据B项分析可知,溶液中含有I-有2mol、Fe2+有4mol、Br-有6mol,所以n(Fe2+):n(I-):n(Br-)=2:1:3,故C正确;D项,因为溶液中含有I-有2mol、Fe2+有4mol、Br-有6mol,所以FeBr2的物质的量应为3mol,所以D错误。此题答案选D。

【题目】表中评价合理的是( )
选项 | 化学反应及其离子方程式 | 评价 |
A | 铁与稀盐酸反应: | 正确 |
B | 大理石溶于醋酸的反应: | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
C | 向Ba(OH)2溶液中滴加少量NaHCO3溶液:Ba2++OH﹣+HCO3﹣=BaCO3↓+H2O | 错误,方程式中Ba2+和OH﹣化学计量数之比为1:2 |
D | NH4HCO3溶液与过量KOH浓溶液共热: | 错误,HCO3﹣也可以与OH﹣反应 |
A.A
B.B
C.C
D.D