题目内容
【题目】向100ml某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2 , 充分反应后,向所得溶液中逐滴滴入1mol/L的盐酸溶液,所得气体的体积(标准状态)与所加盐酸的体积关系如图所示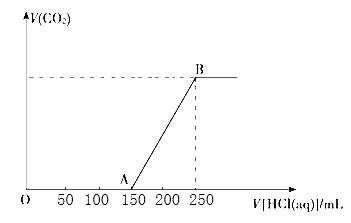
(1)写出OA+段发生反应的离子方程式:。
(2)反应到B点时所得溶液中的溶质是。
(3)原NaOH溶液的物质的量浓度是。
【答案】
(1)OH-+H+=H2O
(2)H++ CO32-= HCO3-NaCl
(3)2.5mol/L
【解析】(1)根据图像可知加入150mL盐酸后开始出现气体,AB段发生的反应是HCO3-+H+=H2O+CO2↑,消耗盐酸是0.1L×1mol/L=0.1mol,对应的碳酸氢钠是0.1mol。由于碳酸钠转化为碳酸氢钠,和碳酸氢钠转化为CO2消耗的盐酸体积相等,这说明反应后的溶液中溶质是氢氧化钠和碳酸钠,根据方程式NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaCl+NaHCO3可知与氢氧化钠反应的盐酸是50mL,所以OA段发生反应的离子方程式为OH-+H+=H2O、H++CO32-=HCO3-。
(2)B点时溶液中的溶质是氯化钠。
(3)根据氯离子守恒可知B点时,反应所得溶液中溶质氯化钠的物质的量为0.25L×1mol/L=0.25mol。根据钠离子守恒可知原氢氧化钠是0.25mol,浓度是0.25mol÷0.1L=2.5mol/L。根据盐酸与混合物反应产生气体的图像分析混合物的组成,结合氢氧化钠与二氧化碳的反应等进行计算即可。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目