题目内容
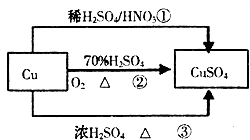
【题目】已知甲、乙、丙是中学常见的三种气体单质,相互间反应可制得化肥B.其转化关系如图1所示:
(1)将B中所含元素填写在如表的恰当位置中(用元素符号表示)
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ||||||||
2 | ||||||||
3 |
(2)已知反应一是放热反应,画出能量关系示意图.
(3)为加快反应一的速率,可采取的措施有:适当升高温度、选用恰当的催化剂、增大某一反应物的浓度和 .
(4)方法一的化学方程式是 .
(5)用方法二也能制得B:甲和丙反应的产物与A反应即可,这两种方法更好的是(填“方法一”或“方法二”),理由是 .
【答案】
(1)H;N;Cl
(2)
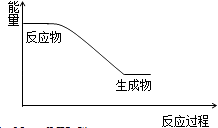
(3)增大压强
(4)3Cl2+8NH3=N2+6NH4Cl
(5)方法二;方法二的原子利用率100%,零排放,符合绿色化学理念
【解析】解:甲、乙、丙是中学常见的三种气体单质,相互间反应可制得化肥B,由转化关系可知,反应一为合成氨,甲、乙分别为氮气、氢气中一种,方法一是氯气与氨气反应生成氯化铵与氮气,丙为氯气、B为NH4Cl.
(1.)B为NH4Cl,含有H元素处于第一周期IA族,N元素处于第二周期VA族,Cl元素处于第三周期ⅦA族,如图所示:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | H | |||||||
2 | N | |||||||
3 | Cl |
所以答案是:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | H | |||||||
2 | N | |||||||
3 | Cl |
;
(2.)反应一是放热反应,则反应物总能量高于生成物总能量,能量关系示意图为:  ,
,
所以答案是:  ;
;
(3.)适当升高温度、选用恰当的催化剂、增大某一反应物的浓度可以加快反应速率,由于有气体参与反应,增大压强,反应速率加快,
所以答案是:增大压强;
(4.)方法一是氯气与氨气反应生成氯化铵与氮气,反应方程式为:3Cl2+8NH3=N2+6NH4Cl,
所以答案是:3Cl2+8NH3=N2+6NH4Cl;
(5.)方法二:甲和丙反应的产物与A反应即可,则甲为氢气、乙为氮气,甲和丙反应的产物为HCl,HCl与氨气反应生成NH4Cl,方法二的原子利用率100%,零排放,符合绿色化学理念,方法二更好,
所以答案是:方法二;方法二的原子利用率100%,零排放,符合绿色化学理念.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案