题目内容
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、N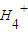 、Cl-、Mg2+、Ba2+、C
、Cl-、Mg2+、Ba2+、C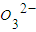 、S
、S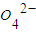 ,现取三份各100mL溶液进行如下实验:
,现取三份各100mL溶液进行如下实验:(1)第一份加入AgNO3溶液有沉淀产生;
(2)第二份加足量NaOH溶液后加热,收集到气体0.04mol;
(3)第三份加足量BaCl2溶液,得沉淀干燥后称重为6.27克,再经足量的盐酸洗涤、干燥后,质量变为2.33克.
根据上述实验,以下推测正确的是( )
A.K+不一定存在
B.100mL溶液中含0.01molC
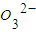
C.Cl-可能存在
D.Ba2+一定不存在,Mg2+可能存在
【答案】分析:根据题意,Ba2+和SO42-,可发生离子反应生成BaSO4↓,因此两者不能共存.Ba2+和CO32-可发生离子反应生成BaCO3↓,因此两者也不能共存.
第一份加入AgNO3溶液有沉淀产生,可能发生Cl-+Ag+═AgCl↓、CO32-+2Ag+═Ag2CO3↓、SO42-+2Ag+═Ag2SO4↓,所以可能含有Cl-、CO32-、SO42-.
第二份加足量NaOH溶液加热后,收集到气体0.04mol,能和NaOH溶液加热产生气体的只能是NH4+,而没有沉淀产生说明一定不存在Mg2+.故可确定一定含有NH4+,一定不存在Mg2+.根据反应NH4++OH-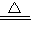 NH3↑+H2O,产生NH3为0.04mol,可得NH4+也为0.04mol.
NH3↑+H2O,产生NH3为0.04mol,可得NH4+也为0.04mol.
第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤.干燥后,沉淀质量为2.33g.部分沉淀溶于盐酸为BaCO3,部分沉淀不溶于盐酸为BaSO4,发生反应CO32-+Ba2+═BaCO3↓、SO42-+Ba2+═BaSO4↓,
因为BaCO3+2HCl═BaCl2+CO2↑+H2O而使BaCO3溶解.因此溶液中一定存在CO32-、SO42-,
一定不存在Ba2+.
由条件可知BaSO4为2.33g,物质的量为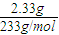 ═0.01mol
═0.01mol
BaCO3为6.27g-2.33g═3.94g,物质的量为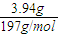 ═0.02mol.
═0.02mol.
则CO32-物质的量为0.02mol,CO32-物质的量浓度为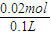 ═0.2mol/L
═0.2mol/L
由上述分析可得,溶液中一定存在CO32-、SO42-、NH4+,一定不存在Mg2+、Ba2+.
结合电荷守恒解答该题.
解答:解:由以上分析可知溶液中一定存在CO32-、SO42-、NH4+,一定不存在Mg2+、Ba2+.
A.CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol,CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.04mol,根据溶液中电荷守恒,可知K+一定存在,故A错误;
B.由上述分析可得,CO32-物质的量为0.02mol,CO32-物质的量浓度为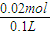 ═0.2mol/L,故B错误;
═0.2mol/L,故B错误;
C.CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol,CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.04mol,根据溶液中电荷守恒,可知K+一定存在,且K+物质的量≥0.02mol,当K+物质的量>0.02mol时,溶液中还必须存在Cl-,故C正确;
D.溶液中一定存在CO32-、SO42-、NH4+,Ba2+和CO32-、SO42-,可发生离子反应生成BaCO3↓、BaSO4↓,因此Ba2+一定不存在.同时第二份加足量NaOH溶液加热后,收集到气体,没有产生沉淀,说明一定不含Mg2+,故D错误;
故选C.
点评:本题考查离子的检验,采用定性实验和定量计算分析相结合的模式,增大了解题难度,同时涉及离子共存、离子反应等都是解题需注意的信息,尤其是K+的确定易出现失误.
第一份加入AgNO3溶液有沉淀产生,可能发生Cl-+Ag+═AgCl↓、CO32-+2Ag+═Ag2CO3↓、SO42-+2Ag+═Ag2SO4↓,所以可能含有Cl-、CO32-、SO42-.
第二份加足量NaOH溶液加热后,收集到气体0.04mol,能和NaOH溶液加热产生气体的只能是NH4+,而没有沉淀产生说明一定不存在Mg2+.故可确定一定含有NH4+,一定不存在Mg2+.根据反应NH4++OH-
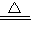 NH3↑+H2O,产生NH3为0.04mol,可得NH4+也为0.04mol.
NH3↑+H2O,产生NH3为0.04mol,可得NH4+也为0.04mol.第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤.干燥后,沉淀质量为2.33g.部分沉淀溶于盐酸为BaCO3,部分沉淀不溶于盐酸为BaSO4,发生反应CO32-+Ba2+═BaCO3↓、SO42-+Ba2+═BaSO4↓,
因为BaCO3+2HCl═BaCl2+CO2↑+H2O而使BaCO3溶解.因此溶液中一定存在CO32-、SO42-,
一定不存在Ba2+.
由条件可知BaSO4为2.33g,物质的量为
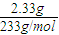 ═0.01mol
═0.01molBaCO3为6.27g-2.33g═3.94g,物质的量为
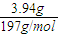 ═0.02mol.
═0.02mol.则CO32-物质的量为0.02mol,CO32-物质的量浓度为
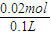 ═0.2mol/L
═0.2mol/L由上述分析可得,溶液中一定存在CO32-、SO42-、NH4+,一定不存在Mg2+、Ba2+.
结合电荷守恒解答该题.
解答:解:由以上分析可知溶液中一定存在CO32-、SO42-、NH4+,一定不存在Mg2+、Ba2+.
A.CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol,CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.04mol,根据溶液中电荷守恒,可知K+一定存在,故A错误;
B.由上述分析可得,CO32-物质的量为0.02mol,CO32-物质的量浓度为
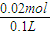 ═0.2mol/L,故B错误;
═0.2mol/L,故B错误;C.CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol,CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.04mol,根据溶液中电荷守恒,可知K+一定存在,且K+物质的量≥0.02mol,当K+物质的量>0.02mol时,溶液中还必须存在Cl-,故C正确;
D.溶液中一定存在CO32-、SO42-、NH4+,Ba2+和CO32-、SO42-,可发生离子反应生成BaCO3↓、BaSO4↓,因此Ba2+一定不存在.同时第二份加足量NaOH溶液加热后,收集到气体,没有产生沉淀,说明一定不含Mg2+,故D错误;
故选C.
点评:本题考查离子的检验,采用定性实验和定量计算分析相结合的模式,增大了解题难度,同时涉及离子共存、离子反应等都是解题需注意的信息,尤其是K+的确定易出现失误.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
今有一混合物的水溶液,含有以下离子中的若干种:Na+、NH+4、Cl-、Ba2+、HCO3-、SO42-,现取三份100mL该溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液,加热,收集到标准状况下的气体448mL
(3)第三份加足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,下列推测正确的是( )
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液,加热,收集到标准状况下的气体448mL
(3)第三份加足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,下列推测正确的是( )
| A、Na+一定存在 | B、100mL该溶液中含0.1mol HCO-3 | C、Ba2+一定存在 | D、Cl-一定不存在 |
今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-.现取两份200mL溶液进行如下实验,根据实验以下推测正确的是( )
①第一份加足量NaOH溶液,加热,收集到气体1.36g;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.
①第一份加足量NaOH溶液,加热,收集到气体1.36g;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.
| A、一定不存在Ba2+,NH4+可能存在 | B、CO32-一定不存在 | C、Na+一定存在 | D、一定不存在Cl- |