题目内容
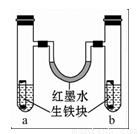
 如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液(呈酸性),各加入生铁块,放置一段时间.下列有关描述正确的是( )
如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液(呈酸性),各加入生铁块,放置一段时间.下列有关描述正确的是( )| A、生铁块中的碳是原电池的正极,发生氧化反应 | B、红墨水柱两边的液面变为左低右高 | C、两试管中相同的电极反应式是:Fe-3e-→Fe3+ | D、a,b试管中均发生了化学能转化为电能的能量变化过程 |
分析:生铁中含有铁和碳,铁、碳和电解质溶液构成了原电池,较活泼的金属铁作负极,碳作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应;a试管中是中性溶液,发生吸氧腐蚀,b试管中是酸性溶液发生析氢腐蚀.
解答:解:A.铁发生吸氧腐蚀和析氢腐蚀时,铁易失电子作负极,则碳都作正极,故A错误;
B.左边试管中是中性溶液,发生吸氧腐蚀,右边试管中是酸性溶液发生析氢腐蚀,所以左边试管内气体的氧气减小,右边试管内气体的压强不大,导致U型管内红墨水左高右低,故B错误;
C.生铁中含有铁和碳,铁、碳和电解质溶液构成了原电池,较活泼的金属铁作负极,碳作正极,负极上铁失电子发生氧化反应Fe-2e-→Fe2+,故C错误;
D.a,b试管中均形成了原电池,在原电池中均发生了化学能转化为电能的能量变化过程,故D正确;
故选:D.
B.左边试管中是中性溶液,发生吸氧腐蚀,右边试管中是酸性溶液发生析氢腐蚀,所以左边试管内气体的氧气减小,右边试管内气体的压强不大,导致U型管内红墨水左高右低,故B错误;
C.生铁中含有铁和碳,铁、碳和电解质溶液构成了原电池,较活泼的金属铁作负极,碳作正极,负极上铁失电子发生氧化反应Fe-2e-→Fe2+,故C错误;
D.a,b试管中均形成了原电池,在原电池中均发生了化学能转化为电能的能量变化过程,故D正确;
故选:D.
点评:本题考查了金属的腐蚀与防护,明确生铁发生吸氧腐蚀和析氢腐蚀的环境是解本题关键,难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
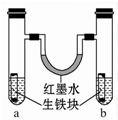
如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入一个生铁块,放置一段时间。下列有关描述错误的是
| A.生铁块中的碳是原电池的正极 |
| B.红墨水柱两边的液面变为左低右高 |
| C.两试管中相同的电极反应式是:Fe-2e-===Fe2+ |
| D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 |
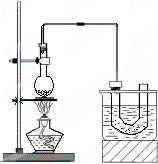 、实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
、实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)