��Ŀ����
����Ŀ��ȫ��������ԭ�����һ�����Ϳɳ��أ���ͬ��̬�ĺ���������Ϊ���������Ļ������ʣ��ֱ��ڸ��Ե����Ե��Һ�����С���ṹԭ����ͼ��ʾ���õ�طŵ�ʱ���Ҳ��еĵ缫��ӦΪ��V2+-e-=V3+������˵����ȷ����
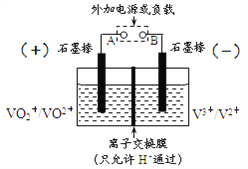
A. �ŵ�ʱ���Ҳ۷�����ԭ��Ӧ
B. �ŵ�ʱ����۵ĵ缫��Ӧʽ��VO2++2H++e-=VO2++H2O
C. ���ʱ��ÿת��1mol���ӣ�n(H+)�ı仯��Ϊ1mol
D. ���ʱ���������ҺpH����
���𰸡�B
��������A����֪��طŵ�ʱ�Ҳ��еĵ缫��ӦΪV2+-e-=V3+��V2+ʧȥ���ӣ�����صĸ���������������Ӧ������A����B���ŵ�ʱ�������ص���������Һ�е�H+�������ƶ������VO2+��VO2+��VԪ�صĻ��ϼ�����д����缫��ӦΪVO2++2H++e- =VO2++H2O����B��ȷ��C���ɷŵ�ʱ��������Ӧʽ֪�����ʱÿת��1mol������H+�����ʵ����ı�2mol������C����D�����ݳ�硢�ŵ�ԭ����֪�����ʱ��������ӦΪVO2++H2O-e- = VO2++2H+�������������Һ��pH������H+����ۣ�������ͨ�����ӽ���Ĥ�����Ҳ����������������������Һ��pHҲ���ͣ���D��������ȷ��ΪB��

��ϰ��ϵ�д�
 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д�
�����Ŀ



