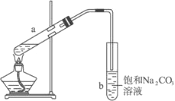
��Ŀ����
����Ŀ����ҵ�����������Ҫ��Ӧ֮һΪ2SO2(g)+O2(g)![]() 2SO3(g)����Ӧ�����������ı仯��ͼ��ʾ��
2SO3(g)����Ӧ�����������ı仯��ͼ��ʾ��
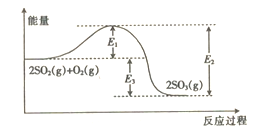
��1����ͼ��֪�÷�Ӧ������ӦΪ_____________(��������������������)��Ӧ��
��2�������¶ȣ�ƽ����_________(��������Ӧ�������淴Ӧ��)�����ƶ�������Ӧ����_____(��������������С����������������ͬ�����淴Ӧ����_____________��
��3����Ӧ��ϵ�м��������ͼ��E1____(��������������С����������������ͬ����E3___________��
��4����֪��2H2S(g)+O2(g)=2S(s)+2H2O(g) ��H=-442.4 kJ��mol-1��
S(s)+O2(g)=SO2(g) ��H=-297.0 kJ mol-1��
��H2S(g)��O2(g)��Ӧ����SO2(g)��H2O(g)���Ȼ�ѧ����ʽ��_________________�����˷�Ӧת��3 mol����ʱ���ų�������Ϊ_______kJ��
���𰸡� ���� �淴Ӧ ���� ���� ��С ���� 2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ��H=-1036.4kJ��mol-1 259.1
��������(1)��Ӧ�з�Ӧ�����������������������������ʷ�ӦΪ���ȷ�Ӧ���ʴ�Ϊ�����ȣ� (2) ���£����ȷ�Ӧ�����ƶ�������Ӧ���淴Ӧ���ʶ����ʴ�Ϊ���淴Ӧ��������������3��������������Խ��ͷ�Ӧ�Ļ��E1������Ӧ��E3���䣬�ʴ�Ϊ����С�����䣻��4�����ݸ�˹���ɷ�������2H2S(g)+O2(g)=2S(s)+2H2O(g) ��H=-442.4 kJ��mol-1��
��S(s)+O2(g)=SO2(g) ��H=-297.0 kJ mol-1������+�ڡ�2���ɵ��Ȼ�ѧ����ʽΪ2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ��H=-442.4-297.0��2=-1036.4kJ��mol-1���÷�Ӧ��ת��12Ħ�����ӣ����Ե�ת��3Ħ������ʱ�ų�������Ϊ1036.4/4= 259.1 kJ���ʴ�Ϊ��2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ��H=-1036.4kJ��mol-1 �� 259.1��

 ���Ž�������С״Ԫϵ�д�
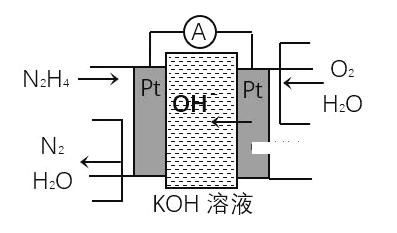
���Ž�������С״Ԫϵ�д�����Ŀ����1���£�N2H4���ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�أ�NO2�Ķ�����N2O4���ǻ���г�������������ȼ�ϵ��ԭ����ͼ��ʾ��ͨ�������ĵ缫�Ϸ����ĵ缫��ӦʽΪ____________________��
��2����2 L�ܱ������У�800 ��ʱ��Ӧ2NO(g)��O2(g) ![]() 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
�ٵ���ƽ��ʱNO��ת����Ϊ_________��
����O2��ʾ��0��2 s�ڸ÷�Ӧ��ƽ������v��____________________��
������ͼ��ʾ����ʾNO2�仯���ߵ���________��
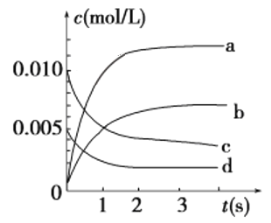
����˵���÷�Ӧ�Ѵﵽƽ��״̬����________(�����)��
A��v(NO2)��2v(O2) B��������ѹǿ���ֲ���
C��v��(NO)��2v��(O2) D�������ڵ��ܶȱ��ֲ���