题目内容
【题目】由Ca3(PO4)2、SiO2 、焦炭等为原料生产硅胶(SiO2·nH2O)、磷、磷酸及CH3OH,下列工艺过程原料综合利用率高,废弃物少。
(1)上述反应中,属于置换反应的是[选填:(Ⅰ)、(Ⅱ)、(Ⅲ)、(Ⅳ)、(Ⅴ)]。
(2)高温下进行的反应Ⅱ的化学方程式为;固体废弃物CaSiO3可用于。(答一条即可)
(3)反应Ⅲ需在隔绝氧气和无水条件下进行,其原因是。
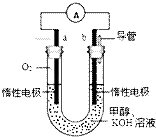
(4)CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为。
(5)指出(VI)这一环节在工业生产上的意义。
(6)写出由P→H3PO4的有关反应式:
①。
②。
【答案】
(1)(Ⅰ)、(Ⅲ)
(2)Ca3(PO4)2+5C+3SiO2![]() 3CaSiO3+2P+5CO↑;生产水泥(砖瓦或作为建筑材料等)
3CaSiO3+2P+5CO↑;生产水泥(砖瓦或作为建筑材料等)
(3)SiHCl3会水解,同时产生的H2 , 与O2混合发生爆炸
(4)CH3OH+H2O-6e-=CO2↑+6H+
(5)原料的循环利用,节能减排
(6)P+O2 ![]() P2O5;P2O5+3H2O=2H3PO4
P2O5;P2O5+3H2O=2H3PO4
【解析】解:(1)根据置换反应的定义知,反应II中反应物中有两种化合物,生成物中含有两种化合物,所以不是置换反应,反应IV中反应物没有单质,所以不是置换反应,反应V是化合反应,Ⅰ、Ⅲ反应符合置换反应的条件,所以是置换反应,
所以答案是:(Ⅰ)、(Ⅲ);
(2)高温条件下,磷酸钙和碳、二氧化硅反应生成硅酸钙、磷和一氧化碳,反应方程式为:Ca3(PO4)2+5C+3SiO2![]() 3CaSiO3+2P+5CO↑,硅酸钙属于硅酸盐,所以可以生产水泥、砖瓦或作为建筑材料等,
3CaSiO3+2P+5CO↑,硅酸钙属于硅酸盐,所以可以生产水泥、砖瓦或作为建筑材料等,
所以答案是:Ca3(PO4)2+5C+3SiO2![]() 3CaSiO3+2P+5CO↑;生产水泥、砖瓦或作为建筑材料等;
3CaSiO3+2P+5CO↑;生产水泥、砖瓦或作为建筑材料等;
(3)R为Si,反应Ⅲ是Si与HCl发生反应得到SiHCl3与氢气,由反应Ⅳ可知,SiHCl3会水解,且生成的氢气和氧气在一定范围内会产生爆炸,故需在隔绝氧气和无水条件下进行,
所以答案是:SiHCl3会水解,同时产生的H2 , 与O2混合发生爆炸等;
(4)甲醇发生氧化反应,酸性条件下,甲醇在负极失电子生成二氧化碳与氢离子,电极反应式为CH3OH+H2O-6e-=CO2+6H+ ,
所以答案是:CH3OH+H2O-6e-=CO2+6H+;
(5)(Ⅵ)这一环节在工业生产上的意义:原料的循环利用,节能减排,
所以答案是:原料的循环利用,节能减排;
(6)由P→H3PO4 , 先由磷与氧气转化为五氧化二磷,再与水化合得到磷酸,有关方程式为①P+O2=P2O5、②P2O5+3H2O=2H3PO4 ,
所以答案是:P+O2=P2O5;P2O5+3H2O=2H3PO4 .

【题目】利用铜萃取剂M,通过如下反应实现铜离子的富集:
(1)X难溶于水、易溶于有机溶剂,其晶体类型为。
(2)X中以sp2杂化、sp3杂化的原子的第一电离能由大到小顺序为。
(3)上述反应中断裂和生成的化学键有(填序号)。
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是。
(5)硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒等功效。取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重如下表。回答下列问题:
温度范围/℃ | 固体质量/g |
258~680 | 3.20 |
680~1000 | 1.60 |
1000以上 | 1.44 |
下图是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子)。
①该温度是。
②铜原子的配位数是。