题目内容
20.现有五种无机物,其性质如下:常温下B、C、D是气体,B具有漂白性,C的水溶液呈碱性,D呈黄绿色;A是B、C形成的酸式盐;E与A的晶体含有相同的阴离子,且E的焰色反应呈黄色.请回答下列问题:(1)写出B、C的溶液反应生成A的离子方程式:NH3•H2O+H2SO3=NH4++HSO3-+H2O.
(2)将体积均为560mL(标准状况)的B和D同事缓缓通入水中得到1.0L溶液,则溶液的pH=1.
(3)物质的量浓度相等的A、E溶液中,阴离子的电离程度较小的是NH4HSO3(填化学式).
(4)在分析化学中,C或其水溶液是一种常用的沉淀剂,用于物质的分离和提纯.向体积为1.0L、浓度为2×10-4mol•L-1的MgCl2溶液中通入C气体,当反应开始有白色沉淀出现时,通入气体C的体积(标准状况)为118.72mL.(已知实验条件下C与水形成的弱电解质的电离常数为1.8×10-5,Ksp[Mg(OH)2]=1.8×10-11.解题时不考虑溶液体积的变化)
分析 常温下B、C、D是气体,B具有漂白性,则B为SO2,C的水溶液呈碱性,则C为NH3,D呈黄绿色,则D为Cl2;A是B、C形成的酸式盐,则A为NH4HSO3,E与A的晶体含有相同的阴离子,且E的焰色反应呈黄色,说明含有Na元素,则E为NaHSO3,结合对应物质的性质以及题目要求解答该题.
解答 解:常温下B、C、D是气体,B具有漂白性,则B为SO2,C的水溶液呈碱性,则C为NH3,D呈黄绿色,则D为Cl2;A是B、C形成的酸式盐,则A为NH4HSO3,E与A的晶体含有相同的阴离子,且E的焰色反应呈黄色,说明含有Na元素,则E为NaHSO3,
(1)氨水中通入过量的二氧化硫,生成亚硫酸氢铵,其反应的离子方程式为:NH3•H2O+H2SO3=NH4++HSO3-+H2O;
故答案为:NH3•H2O+H2SO3=NH4++HSO3-+H2O;
(2)已知气体体积为560mL(标准状况),则其物质的量为:n=$\frac{0.56L}{22.4L/mol}$=0.025mol,二氧化硫和氯气的反应为Cl2+SO2+2H2O═H2SO4+2HCl,0.025mol氯气和二氧化硫反应生成0.025mol硫酸和0.05mol盐酸,则溶液中氢离子的物质的量为0.1mol,氢离子浓度为$\frac{0.1mol}{1L}$=0.1mol/L,则溶液的pH=1;
故答案为:1;
(3)物质的量浓度相等的NH4HSO3、NaHSO3溶液中,由于NH4HSO3中存在相互促进的水解,NH4HSO3中阴离子的电离程度较小;
故答案为:NH4HSO3;
(4)开始有白色沉淀出现时,c(OH-)=$\sqrt{\frac{1.8×1{0}^{-11}}{2.0×1{0}^{-4}}}$mol/L=3×l0-4mol/L,
结合氨水的电离平衡常数=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{{c}^{2}(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=1.8×l0-5,c(NH3.H2O)=5×l0-3mol/L,
未电离前c(NH3.H2O)=5×l0-3mol/L+3×l0-4mol/L=5.3×l0-3mol/L,
n(NH3)=5.3×l0-3mol,
通入氨气的体积=5.3×l0-3mol/L×22.4L/mol=0.11872L=118.72mL,
故答案为:118.72mL.
点评 本题考查无机物的推断,侧重于学生的分析能力和推断能力的考查,注意元素化合物知识的积累,把握常见物质的性质,难度中等.

| A. | 用天然气代替汽油和柴油作发动燃料 | |
| B. | 开发、使用新能源 | |
| C. | 禁止未经处理的工业废水和生活污水的任意排放 | |
| D. | 大量使用农药,提高粮食产量 |
| A. | Cu与4HNO3(浓)反应 | |
| B. | Cu与8HNO3(稀)反应 | |
| C. | Cu在空气加热后生成CuO,再将CuO与硝酸反应 | |
| D. | Cu在氯气加热后生成CuCl2,再将CuCl2溶于硝酸 |
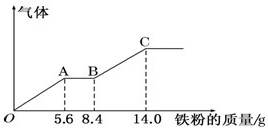 某稀硫酸和稀硝酸的混合溶液200mL,平均分成甲、乙两份.向甲中逐渐加入铜粉,最多能溶解9.6g.向乙中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知:Fe+4HNO3(稀)=Fe(NO3)+NO↑+2H2O),下列分析结果不正确的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成甲、乙两份.向甲中逐渐加入铜粉,最多能溶解9.6g.向乙中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知:Fe+4HNO3(稀)=Fe(NO3)+NO↑+2H2O),下列分析结果不正确的是( )| A. | 原混合溶液中NO${\;}_{3}^{-}$的物质的量的浓度为4mol/L | |
| B. | AB段的反应为:Fe+2Fe3+=3Fe2+ | |
| C. | C点时,乙中溶质为FeSO4 | |
| D. | 标准状况下,OA,OB段产生的气体总体积约为4.48L |
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
其中甲为恒温恒容容器,乙为恒温恒压容器、丙为恒容绝热容器;实验测得起始、平衡时的有关数据如下表:
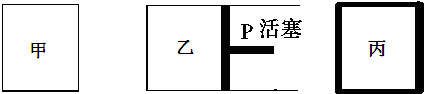
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 1 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A. | N2的转化率:丙是甲的二倍 | |
| B. | 三个容器内反应的平衡常数:甲=乙>丙 | |
| C. | 达平衡时氨气的体积分数:甲>乙>丙 | |
| D. | 放出热量关系:b<a<92.4 |

 .
.