题目内容
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)Si3N4(s)+6CO(g)
(1)该反应的氧化剂是 ,其还原产物是 ;
(2)该反应的平衡常数表达式为K= ;
(3)若知上述反应为放热反应,则其反应热△H 0(填“>”、“<”或“=”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);若已知CO生成速率为v(CO)=18molL﹣1min﹣1,则N2消耗速率为v(N2)= ;
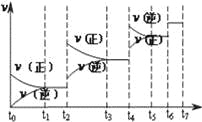
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图.图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中CO的含量最高的一段时间是 .
【答案】(1)N2;Si3N4;
(2)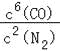 ;
;
(3)<;减小;6mol/(Lmin);
(4)增大压强;t3﹣t4.
【解析】试题分析:(1)所含元素化合价降低的反应物为氧化剂,氧化剂发生还原反应生成还原产物;
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,注意固体、纯液体浓度为常数,不用写固体、纯液体的浓度;
(3)对于放热反应,反应热△H<0;该反应为放热反应,升高温度平衡逆反应进行,化学平衡常数减小;根据速率之比等于化学计量数之比计算;
(4)若不改变H2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为压缩体积增大压强;t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂,t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高.
解:(1)所含元素化合价降低的反应物是氧化剂,氧化剂被还原得到的生成物是还原产物,所以N2是氧化剂,Si3N4是还原产物.
故答案为:N2;Si3N4;
(2)3SiO2(s)+6C(s)+2N2(g)Si3N4(s)+6CO(g)平衡常数表达式为K=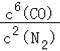 ,故答案为:
,故答案为: ;
;
(3)对于放热反应,反应热△H<0;该反应为放热反应,升高温度平衡逆反应进行,化学平衡常数减小;已知CO生成速率为v(CO)=18mol/(Lmin),根据速率之比等于化学计量数之比,则N2消耗速率为:v(N2)=![]() v(CO)=
v(CO)=![]() ×18mol/(Lmin)=6mol/(Lmin),
×18mol/(Lmin)=6mol/(Lmin),
故答案为:<;减小;6mol/(Lmin);
(4)若不改变H2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为压缩体积增大压强;t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂,t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高,故答案为:增大压强;t3﹣t4.

 小学教材完全解读系列答案
小学教材完全解读系列答案
