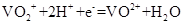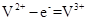题目内容
锂离子电池的广泛应用使回收利用锂资源成为重要课题:某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:

(1)第②步反应得到的沉淀X的化学式为 。
(2)第③步反应的离子方程式是 。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有 。
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:
、 。
(4)若废旧锂离子电池正极材料含LiMn2O4的质量为18.1 g,第③步反应中加入20.0mL 2.5mol·L-1的H2SO4溶液。正极材料中的锂经反应③和④完全转化为Li2CO3,至少有 g Na2CO3参加了反应。

(1)第②步反应得到的沉淀X的化学式为 。
(2)第③步反应的离子方程式是 。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有 。
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:
、 。
(4)若废旧锂离子电池正极材料含LiMn2O4的质量为18.1 g,第③步反应中加入20.0mL 2.5mol·L-1的H2SO4溶液。正极材料中的锂经反应③和④完全转化为Li2CO3,至少有 g Na2CO3参加了反应。
(1)Al(OH)3(2分)
(2)4 LiMn2O4+O2+4H+=4Li++8MnO2+2H2O (2分)
(3) 漏斗玻璃棒烧杯(3分); 滤纸破损、滤液超过滤纸边缘等(2分)
(4)5.3(2分)
(2)4 LiMn2O4+O2+4H+=4Li++8MnO2+2H2O (2分)
(3) 漏斗玻璃棒烧杯(3分); 滤纸破损、滤液超过滤纸边缘等(2分)
(4)5.3(2分)
正极材料包括LiMn2O4、碳粉、铝箔,其中的铝箔可溶合地碱液:①2Al+2NaOH+2H2O=2NaAlO2+3H2↑
过滤后,向滤液中通入过量的CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故沉淀X为Al(OH)3;滤渣为LiMn2O4、碳粉,向加稀硫酸并通入空气LiMn2O4溶解:4 LiMn2O4+O2+4H+=4Li++8MnO2+2H2O,过滤得到滤渣MnO2及碳粉;滤液加入碳酸钠:2Li++CO32-=Li2CO3↓,过滤可得到Li2CO3
过滤过程中所需要的玻璃仪器包括漏斗玻璃棒烧杯;若过滤时发现滤液中有少量浑浊,可能是由于滤纸破损、滤液超过滤纸边缘等原因造成
过滤后,向滤液中通入过量的CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故沉淀X为Al(OH)3;滤渣为LiMn2O4、碳粉,向加稀硫酸并通入空气LiMn2O4溶解:4 LiMn2O4+O2+4H+=4Li++8MnO2+2H2O,过滤得到滤渣MnO2及碳粉;滤液加入碳酸钠:2Li++CO32-=Li2CO3↓,过滤可得到Li2CO3
过滤过程中所需要的玻璃仪器包括漏斗玻璃棒烧杯;若过滤时发现滤液中有少量浑浊,可能是由于滤纸破损、滤液超过滤纸边缘等原因造成

练习册系列答案
相关题目
 。下列说法正确的是
。下列说法正确的是