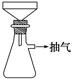
题目内容
硫酸亚铁铵的化学式为(NH4)2Fe(SO4)2?6H2O,商品名为摩尔盐.硫酸亚铁可与硫酸铵生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成摩尔盐后就比较稳定了.三种盐的溶解度(单位为g/100g水)如下表
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2Fe(SO4)2?6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
(1)完成实验步骤中的填空:
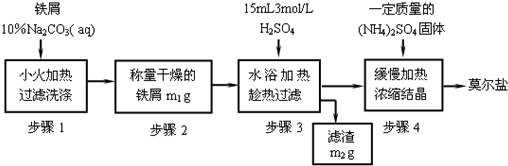
①称取4g铁屑,放入小烧杯,加入15mL10%Na2CO3溶液,小火加热10min以除去______,倒掉溶液,用蒸馏水把铁冲洗干净,干燥,备用;
②将处理好的铁屑放入小烧杯,加入15mL 3mol/L H2SO4溶液,水浴加热至不再有气体生成为止,趁热过滤去剩余铁屑,并用少量热水洗涤烧杯及滤纸,并将滤液和洗涤液一起转移到蒸发皿中,则蒸发皿中溶液的溶质为______(填名称,不考虑水解),其物质的量约为______mol;
③加入______g硫酸铵到蒸发皿中,缓缓加热、浓缩至表面出现结晶膜为止、冷却,得硫酸亚铁铵晶体.
(2)回答下列问题:
①硫酸亚铁溶液在空气中易被氧化变质,操作时应注意:a______;b______;
②加热、浓缩溶液时,不浓缩至干的理由是______;
③硫酸亚铁和硫酸铵的混合溶液加热浓缩就能得到硫酸亚铁铵晶体,其原因是______;
④称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液.用未知浓度的KMnO4酸性溶液进行滴定.
Ⅰ) 滴定时,将KMnO4酸性溶液装在______(酸式或碱式)滴定管,操作时用______手拿锥形瓶;
Ⅱ) 已知MnO4-被还原为Mn2+,试写出该滴定过程中的离子方程式:______;
Ⅲ) 判断该反应到达滴定终点的现象为______;
Ⅳ) 假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为______mol/L.
解:(1)①铁屑表面的油污属于酯类,在热碱性溶液中能被水解掉,故答案为:铁屑表面的油污;
②铁和稀硫酸反应的产物是硫酸亚铁,根据反应:Fe+H2SO4═FeSO4+H2↑,消耗的稀硫酸的量和生成的硫酸亚铁的量相等即n=0.015L×3mol/L=0.045mol,故答案为:硫酸亚铁;0.045;
③根据(NH4)2Fe(SO4)2?6H2O~(NH4)2SO4~FeSO4,则硫酸铵的物质的量为0.045mol,质量m=nM=0.045mol×132g/mol=5.94g,故答案为:5.94;
(2)①硫酸亚铁溶液在空气中易被氧化变质,为避开氧气的氧化,要求过滤洗涤操作速度要快并且步骤③要缓缓加热,避免沸腾;故答案为:过滤洗涤操作速度要快;步骤③要缓缓加热,避免沸腾;
②硫酸亚铁铵晶体中的结晶水受热容易失去,蒸干会使晶体分解,故答案为:因为析出的是硫酸亚铁铵晶体,带有结晶水,蒸干会使晶体分解;
③根据表中所示的在不同温度下的溶解度数据,可以看出相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小,所以将硫酸亚铁和硫酸铵的混合溶液加热浓缩就能得到硫酸亚铁铵晶体,故答案为:因为相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小;
④Ⅰ)高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,所以将KMnO4酸性溶液装在酸式滴定管中,滴定时右手拿锥形瓶,左手控制活塞,故答案为:酸式;右;
Ⅱ)高锰酸根具有氧化性,亚铁离子具有还原性,氧化还原反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
Ⅲ)高锰酸钾本身有颜色,滴定亚铁离子不需要指示剂,当滴加最后一滴溶液后,溶液变成紫红色,30S内不褪色,说明达到滴定终点,故答案为:当滴加最后一滴溶液后,溶液变成紫红色,30S内不褪色,说明达到滴定终点;
Ⅳ)1.96g硫酸亚铁铵晶体的物质的量n= =
= =0.005mol,根据原子守恒则亚铁离子的物质的量为0.005mol,反应5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,则5Fe2+~MnO4-,所以高锰酸钾的物质的量为0.001mol,据c=
=0.005mol,根据原子守恒则亚铁离子的物质的量为0.005mol,反应5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,则5Fe2+~MnO4-,所以高锰酸钾的物质的量为0.001mol,据c= =
=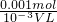 =
=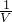 mol/l,故答案为:
mol/l,故答案为: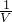 .
.
分析:(1)油污属于酯类,在热碱性溶液中能被水解掉,铁和稀硫酸反应的产物是硫酸亚铁,反应中消耗的稀硫酸的量和生成的硫酸亚铁的量相等;
(2)亚铁离子具有较强的还原性,能被氧气或高锰酸钾氧化,硫酸亚铁铵晶体中的结晶水受热容易失去;相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小;高锰酸钾具有强氧化性,能腐蚀橡胶,滴定时右手拿锥形瓶,左手控制活塞,高锰酸钾本身有颜色,滴定亚铁离子是不需要指示剂的,根据亚铁离子和高锰酸根反应的实质,可以找到亚铁离子与高锰酸根之间的量的关系,根据原子守恒可以找到亚铁离子和酸亚铁铵之间量的关系,进而进行计算.
点评:本题是一道有关滴定知识的大型实验题目,综合性较强,难度较大.
②铁和稀硫酸反应的产物是硫酸亚铁,根据反应:Fe+H2SO4═FeSO4+H2↑,消耗的稀硫酸的量和生成的硫酸亚铁的量相等即n=0.015L×3mol/L=0.045mol,故答案为:硫酸亚铁;0.045;
③根据(NH4)2Fe(SO4)2?6H2O~(NH4)2SO4~FeSO4,则硫酸铵的物质的量为0.045mol,质量m=nM=0.045mol×132g/mol=5.94g,故答案为:5.94;
(2)①硫酸亚铁溶液在空气中易被氧化变质,为避开氧气的氧化,要求过滤洗涤操作速度要快并且步骤③要缓缓加热,避免沸腾;故答案为:过滤洗涤操作速度要快;步骤③要缓缓加热,避免沸腾;
②硫酸亚铁铵晶体中的结晶水受热容易失去,蒸干会使晶体分解,故答案为:因为析出的是硫酸亚铁铵晶体,带有结晶水,蒸干会使晶体分解;
③根据表中所示的在不同温度下的溶解度数据,可以看出相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小,所以将硫酸亚铁和硫酸铵的混合溶液加热浓缩就能得到硫酸亚铁铵晶体,故答案为:因为相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小;
④Ⅰ)高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,所以将KMnO4酸性溶液装在酸式滴定管中,滴定时右手拿锥形瓶,左手控制活塞,故答案为:酸式;右;
Ⅱ)高锰酸根具有氧化性,亚铁离子具有还原性,氧化还原反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
Ⅲ)高锰酸钾本身有颜色,滴定亚铁离子不需要指示剂,当滴加最后一滴溶液后,溶液变成紫红色,30S内不褪色,说明达到滴定终点,故答案为:当滴加最后一滴溶液后,溶液变成紫红色,30S内不褪色,说明达到滴定终点;
Ⅳ)1.96g硫酸亚铁铵晶体的物质的量n=
 =
= =0.005mol,根据原子守恒则亚铁离子的物质的量为0.005mol,反应5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,则5Fe2+~MnO4-,所以高锰酸钾的物质的量为0.001mol,据c=
=0.005mol,根据原子守恒则亚铁离子的物质的量为0.005mol,反应5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,则5Fe2+~MnO4-,所以高锰酸钾的物质的量为0.001mol,据c= =
=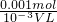 =
=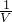 mol/l,故答案为:
mol/l,故答案为: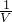 .
.分析:(1)油污属于酯类,在热碱性溶液中能被水解掉,铁和稀硫酸反应的产物是硫酸亚铁,反应中消耗的稀硫酸的量和生成的硫酸亚铁的量相等;
(2)亚铁离子具有较强的还原性,能被氧气或高锰酸钾氧化,硫酸亚铁铵晶体中的结晶水受热容易失去;相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小;高锰酸钾具有强氧化性,能腐蚀橡胶,滴定时右手拿锥形瓶,左手控制活塞,高锰酸钾本身有颜色,滴定亚铁离子是不需要指示剂的,根据亚铁离子和高锰酸根反应的实质,可以找到亚铁离子与高锰酸根之间的量的关系,根据原子守恒可以找到亚铁离子和酸亚铁铵之间量的关系,进而进行计算.
点评:本题是一道有关滴定知识的大型实验题目,综合性较强,难度较大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
硫酸亚铁铵的化学式为(NH4)2SO4?FeSO4?6H2O,是浅绿色晶体,商品名为莫尔盐,易溶于水,不溶于乙醇.
完成下面的实验报告:
【实验原理】
【实验用品】
10%Na2CO3溶液、Fe屑、3mol/LH2SO4、(NH4)2SO4固体、蒸馏水、无水乙醇.锥形瓶、蒸发皿、酒精灯、玻璃棒、烧杯、铁架台、漏斗、托盘天平、量筒、滤纸.
【实验步骤】
(1)Fe屑的处理和称量
称取3g铁屑,放入锥形瓶,用l0%Na2CO3溶液,除去Fe屑表面的油污,将剩余的碱液倒掉,用蒸馏水把Fe冲洗干净,干燥后称其质量m1g.
(2)FeSO4的制备
将称量好的Fe屑放人锥形瓶中,加入l5mL 3mol/LH2SO4,加热10min后(有氢气生成,用明火加热注意安全). ,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中.将滤纸上的固体干燥后称得质量为m2g.
①a处的操作是 ;
②制取FeSO4时,加入的Fe为什么要过量?(用离子方程式表示)
(3)(NH4)2SO4?FeSO4?6H2O的制备
根据FeSO4的物质的量,计算并称取(NH4)2SO4固体,并将其加入上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止. ,得到硫酸亚铁铵的晶体.过滤后用无水乙醇洗涤晶体,除去其表面的水分,称量得到的晶体质量为m3g.
①b处的操作是 ;②制备莫尔盐晶体时,为什么不能将溶液蒸发至干?
(4)产品检验
微量Fe3+的分析.称0.5g产品置于25mL比色管中,加水溶解后加1mL 25%的KSCN溶液,继续加水至25mL刻度,摇匀,与教师所给标准对比,评价产品质量.写出该过程所发生反应的离子方程式:
【实验记录】
| 温度/℃ 溶解度/g 盐 |
0 | 10 | 20 | 30 | 40 | 50 | 60 |
| (NH4)2SO4 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | - | 88.0 |
| FeSO4?7H2O | 15.7 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 | - |
| (NH4)SO4FeSO4?6H2O | 12.5 | 17.2 | 21.6 | 28.1 | 33.0 | 40.0 | - |
【实验原理】
【实验用品】
10%Na2CO3溶液、Fe屑、3mol/LH2SO4、(NH4)2SO4固体、蒸馏水、无水乙醇.锥形瓶、蒸发皿、酒精灯、玻璃棒、烧杯、铁架台、漏斗、托盘天平、量筒、滤纸.
【实验步骤】
(1)Fe屑的处理和称量
称取3g铁屑,放入锥形瓶,用l0%Na2CO3溶液,除去Fe屑表面的油污,将剩余的碱液倒掉,用蒸馏水把Fe冲洗干净,干燥后称其质量m1g.
(2)FeSO4的制备
将称量好的Fe屑放人锥形瓶中,加入l5mL 3mol/LH2SO4,加热10min后(有氢气生成,用明火加热注意安全).
①a处的操作是
②制取FeSO4时,加入的Fe为什么要过量?(用离子方程式表示)
(3)(NH4)2SO4?FeSO4?6H2O的制备
根据FeSO4的物质的量,计算并称取(NH4)2SO4固体,并将其加入上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止.
①b处的操作是
(4)产品检验
微量Fe3+的分析.称0.5g产品置于25mL比色管中,加水溶解后加1mL 25%的KSCN溶液,继续加水至25mL刻度,摇匀,与教师所给标准对比,评价产品质量.写出该过程所发生反应的离子方程式:
【实验记录】
| 起始铁的质量m1/g | 反应后铁的质量m2/g | 莫尔盐的质量 | 产率 | |
| 理论产量/g | 实际产量m3/g | |||
| 5.0 | 2.2 | c | 14.7 | d |
 【实验化学】
【实验化学】