��Ŀ����
����Ŀ��SO2��CO��CO2��NOx�ǶԻ���Ӱ��ϴ�ļ������壬�����ǵĺ������ƺ��������Ż��������滷������Ч;����
��1�����õ绯ѧԭ����CO��SO2ת��Ϊ��Ҫ����ԭ�ϣ�װ����ͼ��ʾ��

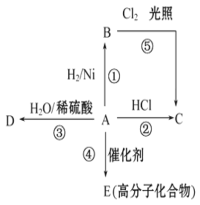
����AΪCO��BΪH2��CΪCH3OH����ͨ��CO��һ���缫��Ӧʽ ��
����AΪSO2��BΪO2��CΪH2SO4�����ĵ缫��ӦʽΪ ��
����AΪNO2��BΪO2��CΪHNO3�����ĵ缫��ӦʽΪ ��
��2��̼����ȼ�ϵ�أ���һ������Li2CO3��Na2CO3���ۻ����Ϊ����ʣ������¶�Ϊ650 �����ڴ��¶�������Ϊ��������ú����CO��H2�������Ϊ1��1��ֱ����ȼ�ϣ��乤��ԭ����ͼ��ʾ��
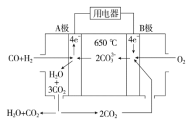
����ظ�����ӦʽΪ ��
���Դ˵�Դ�����������������Һ�����������������Ϊ21.6 g������������������������Ϊ L��������Һ���Ϊ2 L����Һ��pHԼΪ ��
���𰸡�
��1����CO+4e-+4H+=CH3OH��
��SO2+2H2O-2e-=SO42-+4H+��
��NO2-e-+H2O=NO3-+2H+��
��2����CO+H2-4e-+2CO32-=3CO2+H2O����1.12��1��
��������
�����������1����ȼ�ϵ���У�ͨ���������ĵ缫��������ͨ�뻹ԭ���ĵ缫�Ǹ������÷�Ӧ��CԪ�ػ��ϼ���+2�۱�Ϊ-2�ۡ�HԪ�ػ��ϼ���0�۱�Ϊ+1�ۣ�����CO������������ͨ��CO�ĵ缫Ϊ�������缫����ʽΪCO+4 e-+4H+=CH3OH���ʴ�Ϊ��CO+4e-+4H+=CH3OH��
����AΪSO2��BΪO2��CΪH2SO4�������϶�������ʧ���Ӻ�ˮ��Ӧ������������Ӻ������ӣ��缫��ӦʽΪSO2+2H2O-2e-=SO42-+4H+���ʴ�Ϊ��SO2+2H2O-2e-=SO42-+4H+��
����AΪNO2��BΪO2��CΪHNO3��������������ԭ��Ӧ�������õ�������ˮ���缫����ʽΪO2+4e-+4H+�T2H2O������������ԭ��Ӧ���缫����ʽΪNO2-e-+H2O=NO3-+2H+���ʴ�Ϊ��NO2-e-+H2O=NO3-+2H+��
��2������ȼ�ϵ���У�������һ����̼������ʧ���Ӻ�̼������ӷ�Ӧ���ɶ�����̼��ˮ���缫��ӦʽΪCO+H2-4e-+2CO32-=3CO2+H2O,�ʴ�Ϊ��CO+H2-4e-+2CO32-=3CO2+H2O��
�������������������Һ������Ϊ������ʧ�������������������Ϸ�����Ӧ��Ag++e-=Ag�����������Ϊ21.6g��0.2mol��ת�Ƶ�����0.2mol���������ϣ�4OH--4e-=2H2O+O2�����������������ʵ�����0.05mol�������1.12L�������������������ʵ���Ϊ0.2mol������Һ������������Ϊ0.2mol��Ũ��Ϊ![]() =1mol/L��������Һ��pHΪ1���ʴ�Ϊ��1.12��1��
=1mol/L��������Һ��pHΪ1���ʴ�Ϊ��1.12��1��

 ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д� ���������ν�ϵ�д�
���������ν�ϵ�д�����Ŀ�����ݼ������ݹ���CH4(g)+4F2(g)=CF4(g)+4HF(g)�ķ�Ӧ����HΪ( )
��ѧ�� | C-H | C-F | H-F | F-F |
����/(kJ/mol) | 414 | 489 | 565 | 155 |
A��+485kJ/mol B��-485kJ/mol C��+1940kJ/mol D��-1940kJ/mol