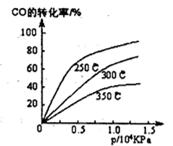
题目内容
在容积不变的密闭容器中加入1 mol N2和3 mol H2发生反应,下列叙述正确的是
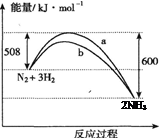

A.该反应的热化学方程式为:N2 + 3H2 2NH3ΔH =-92 kJ/mol 2NH3ΔH =-92 kJ/mol |
| B.达到平衡后向容器中通入1 mol氦气,平衡不移动 |
| C.曲线b表示可能使用了催化剂 |
| D.降低温度和缩小容器体积均可使该反应平衡常数增大 |
BC
试题分析:A、热化学方程式中应该在反应物与生成物的后边标明物质的聚集状态,错误;B、达到平衡后向容器中通入1 mol氦气,因为体积是固定的,不影响各种物质的浓度,因此各种物质的速率不变,从而平衡不移动,正确;C、正确;D、该平衡正向是一个放热反应,降低温度时,平衡正向移动,增大了平衡常数,缩小体积时,因为温度不变,因而平衡常数不变,错误。

练习册系列答案
相关题目
 2(t-BuNO)。在20℃时,向2 L正庚烷中加入(t-BuNO)2 1.0 mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为75%(假设反应过程中溶液体积始终为2 L)。下列说法正确的是
2(t-BuNO)。在20℃时,向2 L正庚烷中加入(t-BuNO)2 1.0 mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为75%(假设反应过程中溶液体积始终为2 L)。下列说法正确的是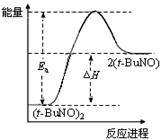
 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g) 
 Fe(s)+CO2(g)+Q
Fe(s)+CO2(g)+Q xC(g) △H<0测得两容器中c(A)随时间t的变化如图所示。
xC(g) △H<0测得两容器中c(A)随时间t的变化如图所示。
 C(g) + D(g)已达平衡状态:
C(g) + D(g)已达平衡状态: 2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若同条件下开始时充入a mo N2和3a mol H2的混合气体,求:
2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若同条件下开始时充入a mo N2和3a mol H2的混合气体,求: 2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求:
2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求: 2SO3(g) △H=-198kJ·mol-1
2SO3(g) △H=-198kJ·mol-1
 cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到
cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到 CH3OH(g)
CH3OH(g)