题目内容
【题目】如图所示是几种常见的化学电源示意图,有关说法正确的是
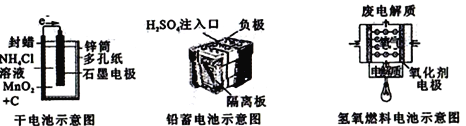
A. 上述电池分别属于一次电池、二次电池和燃料电池
B. 干电池工作时,H+向锌筒移动
C. 铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207g
D. 氢氧燃料电池的正极反应一定是O2+4e-+2H2O=4OH-
【答案】A
【解析】A、干电池是一次性电池,铅蓄电池是可充电电池属于二次电池,氢氧燃料电池属于燃料电池,选项A正确;B、在干电池中,Zn作负极,H+向正极石墨电极移动,选项B错误;C、铅蓄电池工作过程中,硫酸铅在负极上析出,该极质量应该增加而非减小,选项C错误;D、若电解质为酸性,则氢氧燃料电池的正极反应是O2+4e-+4H+=2H2O,选项D错误。答案选A。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响;(Ⅱ)实验①和③探究温度对反应速率的影响;(Ⅲ)实验①和④探究________对反应速率的影响 |
② | 25 | 粗颗粒 | _______ | |
③ | _______ | 粗颗粒 | 2.00 | |
④ | _________ | 细颗粒 | ______ |
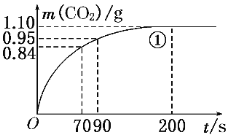
(2)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。在O~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________。