题目内容
下列与实验相关的叙述正确的是
| A.用苯萃取溴水中的Br2时,有机层从分液漏斗的下端放出 |
| B.检验溶液中是否含有SO42-:依次滴入Ba(NO3)2溶液和稀盐酸 |
| C.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 |
| D.配制AlCl3溶液时,将AlCl3溶解在较浓的盐酸中,再用水稀释到所需浓度 |
D
解析试题分析:A、苯的密度比水的密度小,应从上口倒出,错误;B、依次滴入稀盐酸和BaCl2,错误;C、应重新配制,错误; D、正确。
考点:考查实验基本操作等相关知识。

练习册系列答案
相关题目
利用下列实验装置能完成相应实验的是
| A.甲用于证明非金属性强弱:Cl>C>Si |
| B.乙用于分离I2和NH4Cl |
| C.丙装置能组成Zn、Cu原电池 |
| D.丁用于测定某稀盐酸的物质的量浓度 |
下列叙述中正确的是 ( )
| A.液溴易挥发,在存放液溴的试剂瓶中应加水封 |
| B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 |
| C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ |
下列实验不能达到预期目的的是
| 序号 | 实验操作 | 实验目的 |
| A | 浓、稀HNO3分别与Cu反应 | 比较浓、稀HNO3的氧化性强弱 |
| B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C | 测定等浓度的HCl、HNO3两溶液的pH | 比较Cl、N的非金属性强弱 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
某同学设计了以下几个实验,其中正确的为
A.实验室从海带提取单质碘的方法是:取样 灼烧 灼烧 溶解 溶解 过滤 过滤 萃取 萃取 |
| B.在配制一定物质的量浓度的溶液时,先称量或量取物质,再溶解或稀释,并将溶液转移至容量瓶,洗涤烧杯和玻璃棒并将洗涤液转移到容量瓶,继续往容量瓶中加水至溶液的凹液面正好与刻度线相切 |
| C.“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须润洗后方可使用 |
| D.欲检验SO2中是否混有CO2,可将该气体依次通过盛有饱和碳酸氢钠溶液、品红溶液、澄清石灰水的洗气瓶,若品红溶液不褪色且澄清石灰水变浑浊,则证明混有CO2 |
下列实验操作正确的是
 |  |  |  |
| A.称量氢氧化钠固体 | B.分离柴油和水 | C.把饱和食盐水中的食盐提取出来 | D.分离两种互溶但沸点相差较大的液体混合物 |
利用实验器材(规格和数量不限),能完成相应实验的一项是( )
| | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、蒸发皿 | 硫酸铜溶液的浓缩结晶 |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体氯化钠配制0.5mol/L的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
下列叙述中正确的是
| A.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 |
| C.液溴易挥发,在存放液溴的试剂瓶中应加水封 |
| D.硝酸亚铁溶液中要加入稀硝酸抑制水解,防止溶液变浑浊 |
关于下列各装置图的叙述中,正确的是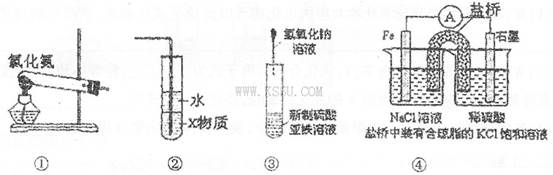
| A.实验室用装置①制取氨气 |
| B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 |
| C.装置③可用于制备氢氧化亚铁并观察其颜色 |
| D.装置④左侧烧杯中c(Cl-)减小 |