题目内容
NA表示阿佛加德罗常数,下列说法正确的是
- A.0.1molFe与0.1molCl2充分反应转移电子数为0.2NA
- B.16g甲基正离子(13CH3+)所含电子数为9NA
- C.关于反应:C2H2(g)+2.5O2(g)→2CO2(g)+H2O(1)+1300kJ,若CO2中有4NA对共用电子对生成,则放出热量为1300kJ
- D.0.1mol/LFe2(SO4)3溶液200mL中阴离子和阳离子总数为0.1NA
A
分析:A、根据铁与氯气的量判断反应的过量问题,然后在计算转移的电子数;
B、先求微粒的质子总数,再根据微粒是否带电荷求电子数;
C、首先判断1molCO2中含有的共用电子对数,再计算反应热;
D、要从水解的角度考虑Fe2(SO4)3溶液的阴阳离子总数.
解答:A、根据反应的化学方程式计算:
2Fe+3Cl2 2FeCl3
2FeCl3
2 3
x 0.1
x=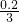 mol
mol
由此可见是Fe有过剩,所以转移的电子数,利用Cl2来计算,则转移的电子数为2×0.1mol=0.2NA,故A正确;
B、因甲基正离子与甲基,质子总数都是6+3(碳原子+3个氢原子),16g甲基正离子的物质的量为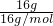 =1mol,但是甲基不带电,电子数等于质子数,所以电子数是9NA,而甲基正离子带1个单位正电荷,说明电子数比质子数少1,所以电子数是8NA,故B错误;
=1mol,但是甲基不带电,电子数等于质子数,所以电子数是9NA,而甲基正离子带1个单位正电荷,说明电子数比质子数少1,所以电子数是8NA,故B错误;
C、1molCO2中有4mol对共用电子对,根据反应:C2H2(g)+2.5O2(g)→2CO2(g)+H2O(1)+1300kJ,若CO2中有4NA对共用电子对生成,说明有1molCO2生成,则放出热量为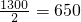 KJ,故C错误;
KJ,故C错误;
D、不考虑水解时0.lmol/LFe2(SO4)3溶液200mL中阴离子和阳离子总数为0.02mol×(2+3)=0.1NA,但Fe2(SO4)3溶液中Fe3+离子发生水解,则阴离子和阳离子总数不等于0.1NA,故D错误.
故选A.
点评:本题考查阿佛加德罗常数的有关知识,做题时注意分析物质存在的条件、聚集状态、物质的结构特点以及物质的性质等问题.关于电子数的计算,要记住思维顺序是:先求微粒的质子总数,再根据微粒是否带电荷求电子数.
分析:A、根据铁与氯气的量判断反应的过量问题,然后在计算转移的电子数;
B、先求微粒的质子总数,再根据微粒是否带电荷求电子数;
C、首先判断1molCO2中含有的共用电子对数,再计算反应热;
D、要从水解的角度考虑Fe2(SO4)3溶液的阴阳离子总数.
解答:A、根据反应的化学方程式计算:
2Fe+3Cl2
 2FeCl3
2FeCl32 3
x 0.1
x=
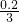 mol
mol由此可见是Fe有过剩,所以转移的电子数,利用Cl2来计算,则转移的电子数为2×0.1mol=0.2NA,故A正确;
B、因甲基正离子与甲基,质子总数都是6+3(碳原子+3个氢原子),16g甲基正离子的物质的量为
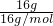 =1mol,但是甲基不带电,电子数等于质子数,所以电子数是9NA,而甲基正离子带1个单位正电荷,说明电子数比质子数少1,所以电子数是8NA,故B错误;
=1mol,但是甲基不带电,电子数等于质子数,所以电子数是9NA,而甲基正离子带1个单位正电荷,说明电子数比质子数少1,所以电子数是8NA,故B错误;C、1molCO2中有4mol对共用电子对,根据反应:C2H2(g)+2.5O2(g)→2CO2(g)+H2O(1)+1300kJ,若CO2中有4NA对共用电子对生成,说明有1molCO2生成,则放出热量为
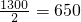 KJ,故C错误;
KJ,故C错误;D、不考虑水解时0.lmol/LFe2(SO4)3溶液200mL中阴离子和阳离子总数为0.02mol×(2+3)=0.1NA,但Fe2(SO4)3溶液中Fe3+离子发生水解,则阴离子和阳离子总数不等于0.1NA,故D错误.
故选A.
点评:本题考查阿佛加德罗常数的有关知识,做题时注意分析物质存在的条件、聚集状态、物质的结构特点以及物质的性质等问题.关于电子数的计算,要记住思维顺序是:先求微粒的质子总数,再根据微粒是否带电荷求电子数.

练习册系列答案
相关题目
下列说法正确的是( )
| A、因为SO2的水溶液能导电,所以SO2是电解质 | B、Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | C、利用丁达尔现象可以区别胶体和溶液 | D、在氢气与氧气的混合气体1.12L中所含原子的数目约为0.1NA(NA 表示阿佛加德罗常数值) |
设NA、表示阿佛加德罗常数值,下列说法正确的是
| A.1000mL0.1mol·L-1的Al2(SO4)3溶液中,含Al3+ 0.1NA |
| B.在标准状况下,11.2L氖气中含有NA个氖原子 |
| C.7.8gNa2O2与足量CO2反应,转移电子数为0.1NA |
| D.62 g Na2O溶于水后所得溶液中含有O2-离子数为NA |