��Ŀ����
����Ӫ���ḻ�����С��߲�֮���������ơ�������������˶���ͬʳ���ý�ʯ��ij��ѧ��ȤС��ԡ����˶����Ƿ���ͬʳ�����������̽����
��֪�����˺��зḻ�����������Ρ�̼���εȣ������к��зḻ�ĵ����ʼ����εȡ������ʯ����Ҫ�ɷ֣�����ƣ�CaC2O4������������Ʒ�Ӧ��������̼��Ʒ�Ӧ���ɿ������εȡ�
��̽��һ�������в��ֳɷַ���

��1��������е�ʵ���Ҳ�������Ҫ�IJ����������ձ�����������________________��
��2����ɫ����B�Ļ�ѧʽ����Ϊ_______________��
��̽������ij����ƾ��壨CaC2O4��xH2O���ȷֽ��о�
����ͼװ�ý�ij����ƾ�����Ʒ���¼��ȣ�ʹ����ȫ�ֽ⣬����������������̽��������װ���и��Լ�����������
��3��ij�о�������SDT Q600�ȷ����ǶԲ���ƾ��壨CaC2O4��xH2O�������ȷֽ⣬��������ݣ����Ƴɹ����������ֽ��¶ȵĹ�ϵ��ͼ��
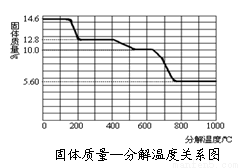
800������ʱ������ɷֵĻ�ѧʽΪ_____________��
��д������������12.8 g��Ϊ10.0 g�����еĵķ�Ӧ����ʽΪ___________��
���Լ������ƾ����x��д��������̣�_______________��
��ϰ��ϵ�д�
�����Ŀ

 H2NCOONH4 ��H <0
H2NCOONH4 ��H <0 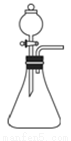
 CH3COOCH2CH3+H2O ֬����Ӧ
CH3COOCH2CH3+H2O ֬����Ӧ 2CH3CHO��H2O ������Ӧ
2CH3CHO��H2O ������Ӧ CH2Cl2+HCl ȡ����Ӧ
CH2Cl2+HCl ȡ����Ӧ Fe(s)+CO2(g)��K=0.5������1L�ܱ������м���0.04mol FeO(s)����ͨ��xmolCO��t��ʱ��Ӧ�ﵽƽ�⡣��ʱFeO(s)��ת����Ϊ50%����x=_______��
Fe(s)+CO2(g)��K=0.5������1L�ܱ������м���0.04mol FeO(s)����ͨ��xmolCO��t��ʱ��Ӧ�ﵽƽ�⡣��ʱFeO(s)��ת����Ϊ50%����x=_______��