��Ŀ����
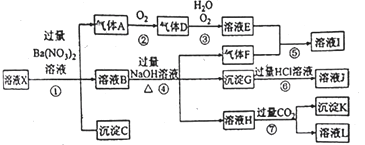
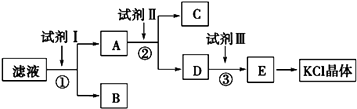
����Ŀ���Ȼ�����Ʒ�к�������̼��ء�����غͲ�����ˮ�����ʣ�Ϊ���ᴿ�Ȼ��أ��Ƚ���Ʒ��������ˮ�У���ֽ������ˣ��ڽ���Һ��ͼ��ʾ������в�����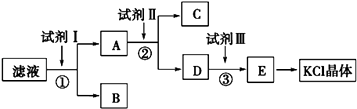
�ش��������⣺
��1��Ϊ������ʼ��Һ�е�Cl�� �� �����Լ�����ϡHNO3 �� ����Ҫ
��2���Լ�I�Ļ�ѧʽΪ �� �ж��Լ�I�Ѽӹ����ķ���
��3���Լ���Ļ�ѧʽΪ���м����Լ����Ŀ����
��4���Լ�������������з�����Ӧ�����ӷ���ʽΪ
��5��ijͬѧ������������KCl����������ԭ��Ʒ����������Ȼ�����Ʒ�Ĵ��ȣ�����Ϊ����ɿ��𣿲�˵�����ɣ�������ʵ����
���𰸡�
��1��AgNO3
��2��BaCl2��ȡ������ҺA�����Լ�����������������ѹ���
��3��K2CO3����ȥǰ������Ĺ�����Ba2+
��4�����CO32��+2H+�TCO2+H2O
��5��
�⣺���ӹ�����K2CO3��K2SO4�е�KԪ�ض�ת��ΪKCl�����Ը�˵�����ɿ����𣺲��ɿ�������KCl���岢����ȫ����ԭ��Ʒ
���������⣺��Һ�к���KCl��K2CO3��K2SO4 �� ����Һ�м������BaCl2��Һ��������ӦCO32��+Ba2+=BaCO3����SO42��+Ba2+=BaSO4�����õ�����BΪBaCO3��BaSO4 �� ��Һ�к���KCl��BaCl2 �� ����Һ�м������K2CO3 �� ��ȥ�����ı����ӣ��õ�����CΪBaCO3 �� D������ΪK2CO3��KCl��Ȼ������Һ�м������HCl��������Ӧ CO32��+2H+=H2O+CO2����Ȼ��������Һ����Һ��HCl�ӷ����������յõ�KCl���壮��1��Ϊ������ʼ��Һ�е�Cl�� �� �����Լ���ϡHNO3 �� ��Ӧ����Ba��NO3��2��ȥCO32����SO42���ĸ��ţ�Ȼ��������������������ӣ������Һ�в�����ɫ������˵�����������ӣ����Դ��ǣ�AgNO3����2��������������֪�Լ�IΪBaCl2 �� �ж��Ȼ����Ƿ��������ȡ������ҺA�����Լ�����������������ѹ�����
���Դ��ǣ�BaCl2��ȡ������ҺA�����Լ�����������������ѹ�������3��������������֪����ΪK2CO3 �� Ŀ���dz�ȥ����ı����ӣ����Դ��ǣ�K2CO3����ȥǰ������Ĺ�����Ba2+����4��������������֪���Լ���Ϊ�������ᣬ�����ķ�ӦΪCO32��+2H+�TCO2+H2O�����Դ��ǣ����CO32��+2H+�TCO2+H2O��

 ����ѵ��ϵ�д�
����ѵ��ϵ�д� ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�