题目内容
【题目】常温下将NaOH溶液滴加到亚硒酸(H2SeO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
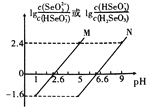
A. Ka1(H2SeO3)的数量级为10-7
B. 曲线M表示pH与lg![]() 的变化关系
的变化关系
C. NaHSeO3溶液中c(OH-)>c(H+)
D. 混合溶液中:lg![]() - lg
- lg![]() =lgKa1(H2SeO3)-lgKa2(H2SeO3)=4
=lgKa1(H2SeO3)-lgKa2(H2SeO3)=4
【答案】D
【解析】分析:当lg![]() 与lg
与lg![]() 相等时,曲线M的pH小于N曲线,H2SeO3分步电离且一级电离常数远大于二级电离常数,曲线M表示pH与lg
相等时,曲线M的pH小于N曲线,H2SeO3分步电离且一级电离常数远大于二级电离常数,曲线M表示pH与lg![]() 的变化关系,曲线N表示pH与lg
的变化关系,曲线N表示pH与lg![]() 的变化关系。根据曲线M上的点(2.6,0)计算Ka1(H2SeO3),进一步计算HSeO3-的水解平衡常数;根据曲线N上的点(6.6,0)计算Ka2(H2SeO3),由HSeO3-的电离平衡常数和水解平衡常数的大小判断NaHSeO3溶液的酸碱性;由电离平衡常数表达式和关键点计算lg
的变化关系。根据曲线M上的点(2.6,0)计算Ka1(H2SeO3),进一步计算HSeO3-的水解平衡常数;根据曲线N上的点(6.6,0)计算Ka2(H2SeO3),由HSeO3-的电离平衡常数和水解平衡常数的大小判断NaHSeO3溶液的酸碱性;由电离平衡常数表达式和关键点计算lg![]() - lg
- lg![]() 。
。
详解:当lg![]() 与lg
与lg![]() 相等时,曲线M的pH小于N曲线,H2SeO3分步电离且一级电离常数远大于二级电离常数,曲线M表示pH与lg
相等时,曲线M的pH小于N曲线,H2SeO3分步电离且一级电离常数远大于二级电离常数,曲线M表示pH与lg![]() 的变化关系,曲线N表示pH与lg
的变化关系,曲线N表示pH与lg![]() 的变化关系。A项,H2SeO3的电离方程式为:H2SeO3
的变化关系。A项,H2SeO3的电离方程式为:H2SeO3![]() H++HSeO3-、HSeO3-
H++HSeO3-、HSeO3-![]() H++SeO32-,H2SeO3的电离平衡常数Ka1(H2SeO3)=
H++SeO32-,H2SeO3的电离平衡常数Ka1(H2SeO3)=![]() ,曲线M上当lg
,曲线M上当lg![]() =0时溶液的pH=2.6,即
=0时溶液的pH=2.6,即![]() =1时溶液中c(H+)=10-2.6mol/L,Ka1(H2SeO3)=10-2.6=100.4
=1时溶液中c(H+)=10-2.6mol/L,Ka1(H2SeO3)=10-2.6=100.4![]() 10-3,Ka1(H2SeO3)的数量级为10-3,H2SeO3的电离平衡常数Ka2(H2SeO3)=
10-3,Ka1(H2SeO3)的数量级为10-3,H2SeO3的电离平衡常数Ka2(H2SeO3)=![]() ,曲线N上当lg
,曲线N上当lg![]() =0时溶液的pH=6.6,即
=0时溶液的pH=6.6,即![]() =1时溶液中c(H+)=10-6.6mol/L,Ka2(H2SeO3)=10-6.6=100.4
=1时溶液中c(H+)=10-6.6mol/L,Ka2(H2SeO3)=10-6.6=100.4![]() 10-7,Ka2(H2SeO3)的数量级为10-7,A项错误;B项,lg
10-7,Ka2(H2SeO3)的数量级为10-7,A项错误;B项,lg![]() 与lg
与lg![]() 相等时,曲线M的pH小于N曲线,H2SeO3分步电离且一级电离常数远大于二级电离常数,曲线M表示pH与lg
相等时,曲线M的pH小于N曲线,H2SeO3分步电离且一级电离常数远大于二级电离常数,曲线M表示pH与lg![]() 的变化关系,B项错误;C项,NaHSeO3溶液中既存在HSeO3-的电离平衡,又存在HSeO3-的水解平衡,HSeO3-水解平衡方程式为HSeO3-+H2O
的变化关系,B项错误;C项,NaHSeO3溶液中既存在HSeO3-的电离平衡,又存在HSeO3-的水解平衡,HSeO3-水解平衡方程式为HSeO3-+H2O![]() H2SeO3+OH-,HSeO3-的水解平衡常数Kh=
H2SeO3+OH-,HSeO3-的水解平衡常数Kh=![]() =
=![]() =
=![]() =
=![]() =10-11.4
=10-11.4![]() Ka2(H2SeO3)=10-6.6,HSeO3-的电离程度大于HSeO3-的水解程度,溶液呈酸性,NaHSeO3溶液中c(H+)
Ka2(H2SeO3)=10-6.6,HSeO3-的电离程度大于HSeO3-的水解程度,溶液呈酸性,NaHSeO3溶液中c(H+)![]() c(OH-),C项错误;D项,lg
c(OH-),C项错误;D项,lg![]() - lg
- lg![]() =lg
=lg![]() -lg
-lg![]() =lgKa1(H2SeO3)-lg Ka2(H2SeO3)=lg10-2.6-lg10-6.6=-2.6-(-6.6)=4,D项正确;答案选D。
=lgKa1(H2SeO3)-lg Ka2(H2SeO3)=lg10-2.6-lg10-6.6=-2.6-(-6.6)=4,D项正确;答案选D。

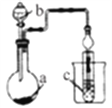
【题目】如图装置,其中试剂b为浓硫酸,则下列实验设计能达到实验目的的是
选项 | 试剂a | 试剂c | 实验目的 |
|
A | MnO2和NaCl | 紫色石蕊溶液 | 验证Cl2的漂白性 | |
B | 蔗糖 | 澄清石灰水 | 验证CO2的生成 | |
C | FeS | 溴水 | 验证非金属性:Br>S | |
D | Na2SO3 | 品红溶液 | 验证SO2的漂白性 |
A. A B. B C. C D. D