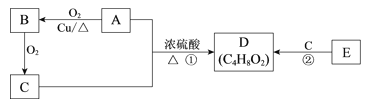
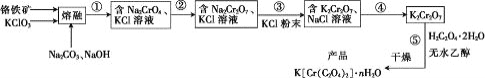
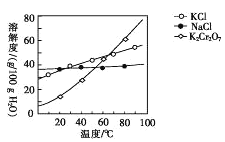
题目内容
【题目】第三周期X、Y、Z、W四种元素的最高价氧化物溶于水可得到四种溶液,0.010 mol/L的这四种溶液在25℃时的pH与该元素原子半径的关系如图所示。下列说法正确的是
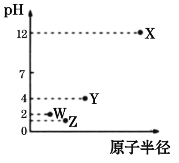
A.简单离子半径:X>Y>Z>W
B.W的氧化物对应的水化物一定是强酸
C.气态氢化物的稳定性:W<Z<Y
D.W与Z可形成一种各原子均达到8电子稳定结构的化合物Z2W2,其结构式为:W-Z-Z-W
【答案】D
【解析】
第三周期元素中,X最高价氧化物水化物的溶液PH为12,氢氧根浓度为0.01mol/L,故为一元强碱,则X为Na;Y、W、Z对应的最高价氧化物水化物的溶液pH均小于7,均为酸,W最高价含氧酸溶液中氢离子浓度为0.01mol/L,故为一元强酸,则W为Cl元素;最高价含氧酸中,Z对应的酸性比W的弱、Y对应的酸性比W的弱,而原子半径Y>Z>Cl,硅酸不溶于水,故Z为S元素,Y为P元素。
A.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径P3>S2>Cl>Na+,故A错误;
B.W的最高价氧化物对应的水化物是高氯酸,一定是强酸,但是如果是次氯酸,则是弱酸,故B错误;
C.非金属性是Y>Z>W,非金属性越强,则气态氢化物的稳定性:Y>Z>W,故C错误;
D.W与Z可形成一种各原子均达到8电子稳定结构的化合物S2Cl2,其结构式为:Cl-S-S-Cl,故D正确;
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
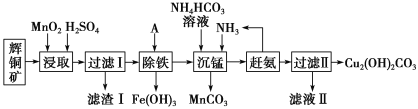
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有____(任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:____。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为____,若加 A 后溶液的 pH调为5,则溶液中 Fe3+的浓度为____mol/L。
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:____。
(5)“赶氨”时,最适宜的操作方法是____。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是____(写化学式)。
(7)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是____。
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如图。
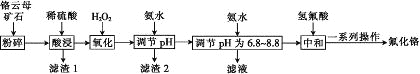
表中列出了相关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 | Fe(OH)2 |
开始沉淀的pH | 2.3 | 8.8 | 4.9 | 7.5 |
沉淀完全的pH | 4.1 | 10.4 | 6.8 | 9.7 |
请回答下列问题:
(1)Fe2O3、MgO、FeO、SiO2中属于碱性氧化物的有________种。
(2)将铬云母矿石粉碎的目的是________。
(3)滤渣1主要成分的用途是________。(写一种)
(4)Cr2O3与稀硫酸反应的化学方程式为___________。
(5)第一次滴加氨水调节pH范围为________。
(6)第二次滴加氨水调节pH为6.8~8.8的目的是_______,Cr(OH)3与 Al(OH)3一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:________。