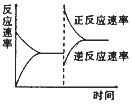
题目内容
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
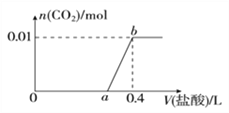
A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
【答案】C
【解析】A、向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸发生的反应依次为H++OH-=H2O、CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑,第三步才开始产生气体,故0-a范围内,发生了前两步反应,A错误;B、ab段立即产生气体,则反应为: HCO3-+H+=H2O+CO2↑,故B错误;C、生成CO2 0.01mol,根据方程式HCO3-+H+=H2O+CO2↑可知,消耗盐酸的物质的量是0.01mol,消耗盐酸的体积为0.1L,所以a=0.3,故C正确;D、生成0.01mol CO2,则Na2CO3为0.01mol,Na2CO3共消耗盐酸0.02mol,从图上可知整个过程共消耗0.04molHCl,所以与NaOH反应的盐酸是0.04mol-0.02mol=0.02mol,则NaOH为0.02mol,因此原混合溶液中NaOH与Na2CO3的物质的量之比为2:1,故D错误。选C。

练习册系列答案
相关题目