题目内容
(6分)某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质。
(1)该小组同学采用了以下操作制备胶体,请将空白处填写完整。
取一个烧杯,加入20mL蒸馏水,加热至沸腾,然后向烧杯中滴加5~6滴 饱 和_______ ___溶液,继续煮沸,至出现_____ ____后,停止加热;
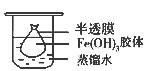
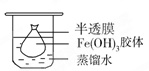
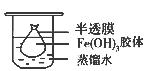
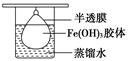
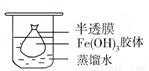
(2)将制得的胶体放入半透膜制成的袋内,如上左图所示,放置2min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察(填写“有”或“无”)_________ 丁达尔现象:再向试管中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为______________________________;
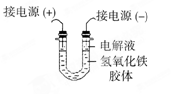
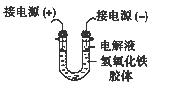
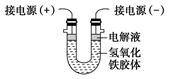
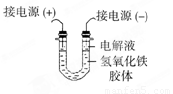
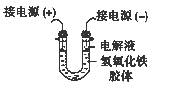
(3)将半透膜内的液体倒入U 型管中,如上右图所示,在液体上方加入少量电解液以保护胶体,接通直流电后,观察到的现象是(填“阴”或“阳”)_____极附近颜色逐渐变深,其原因是_____________________________________。
【答案】
(6分)
(1)FeCl3 红褐色
(2)无 有白色沉淀
(3)阴 Fe(OH)3胶体粒子带正电
【解析】考查胶体的制备及胶体的性质。
(1)制备氢氧化铁胶体时,应该用新配制的饱和的氯化铁溶液,滴入沸腾的蒸馏水中,至出现红褐色后,停止加热。
(2)胶体不能透过半透膜,所以袋外液体不能产生丁达尔效应。由于氯离子能透过半透膜,所以加入硝酸银后能产生氯化银白色沉淀。
(3)氢氧化铁胶体的胶粒能吸附阳离子,因此带正电荷,所以胶粒向阴极移动,即阴极周围颜色逐渐变深。

练习册系列答案
相关题目