题目内容
【题目】下列微粒:①CH4②NH3③CH3C00 -④NH4+⑤H20 中含有配位键的是
A. ①② B. ①③ C. ④⑤ D. ②④
【答案】C
【解析】①甲烷中碳原子满足8电子稳定结构,氢原子满足2电子稳定结构,无空轨道,无孤电子对,CH4不含有配位键;②氨气分子中氮原子含有孤电子对,但氢原子不含空轨道,所以不能形成配位键;③CH3COO-中碳和氧最外层有8个电子达到稳定结构,氢满足2电子稳定结构,无空轨道,无孤电子对,不含有配位键;④氨气分子中氮原子含有孤电子对,氢离子提供空轨道,可以形成配位键,NH4+含有配位键;⑤H3O+中O提供孤电子对,H+提供空轨道,二者形成配位键,H3O+含有配位键;答案选C。

【题目】TiCl4是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4,设计实验如下(夹持装置略去);
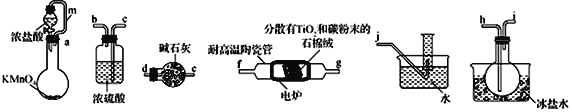
相关信息如下表所示:
熔点/℃ | 沸点/℃ | 密度/(g cm-3) | 水溶性 | |
TiCl4 | -25 | 136 | 1.5 | 易水解,能溶于有机溶剂 |
CC14 | -23 | 76.8 | 1.6 | 难溶于水 |
请回答下列问题:
(1)按照气流由左到右的方向,上述装置合理的连接顺序为_____________(填仪器接口字母)
(2)根据完整的实验装置进行实验,实验步骤如下:检査装置气密性后,装入药品;_____________
(按正确的顺序填入下列操作的字母)。
A.关闭分液漏斗活塞 B.停止加热,充分冷却
C.打开分液漏斗活塞 D.加热装置D中陶瓷管
实验时,当观察到______________时,开始进行步骤D。
(3)装置A中导管m的作用为_______________________。
(4)装置C的作用为 ___________________________________________。
(5)装置D中除生成TiCl4外,同时生成一种气态不成盐氧化物,该反应的化学方程式为__________________________________。
(6)设计实验证明装置 F中收集到的液体中含有TiCl4:______________________________________________。
(7)制得的TiCl4中常含有少量CCl4,从混合液体中分离出TiCl4的操作名称为_________________。
【题目】某同学按下图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液。请回答下列问题。
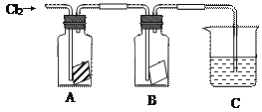
(1)通入Cl2一段时间后,A、B装置中,红色纸条的现象和结论为:
装置 | 现象 | 结论 |
A | ______________ | 潮湿的氯气______(填能或不能)使红色纸条褪色,因为反应生成的____________具有漂白性 |
B | ______________ |
(2)C装置的作用是__________________________
写出装置C中反应的化学方程式:_________________________________
