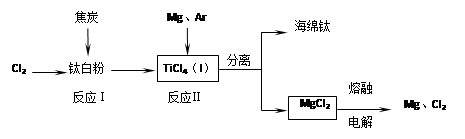题目内容
(10分)某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如下图所示。
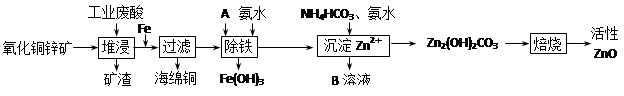
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
请回答下列问题:
⑴氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)(Ksp 沉淀离子浓度积)。
⑵物质A可使用下列物质中的 。
A.KMnO4 B.O2 C.H2O2 D.Cl2
⑶除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
⑷物质B可直接用作氮肥,则B的化学式是 。
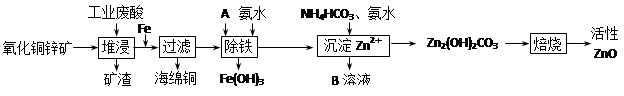
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
⑴氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)(Ksp 沉淀离子浓度积)。
⑵物质A可使用下列物质中的 。
A.KMnO4 B.O2 C.H2O2 D.Cl2
⑶除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
⑷物质B可直接用作氮肥,则B的化学式是 。
⑴< ⑵BC ⑶3.2~6.2 ⑷(NH4)2SO4
(1)在H2SO4的作用下ZnS可以溶解而CuS不溶,说明硫化铜更难溶,因此溶度积常数小于硫化锌的。
(2)A是氧化溶液中的亚铁离子的,由于不能引入杂质,所以应该选择臭氧和双氧水,答案选BC。
(3)关键表中数据可知,铁离子完全沉淀的pH是3.2,而锌离子开始沉淀的pH是6.2,所以pH的范围是3.2~6.2。
(4)物质B可直接用作氮肥,则B是铵盐,因此是(NH4)2SO4。
(2)A是氧化溶液中的亚铁离子的,由于不能引入杂质,所以应该选择臭氧和双氧水,答案选BC。
(3)关键表中数据可知,铁离子完全沉淀的pH是3.2,而锌离子开始沉淀的pH是6.2,所以pH的范围是3.2~6.2。
(4)物质B可直接用作氮肥,则B是铵盐,因此是(NH4)2SO4。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2Fe+3CO2
2Fe+3CO2 2Hg+O2↑
2Hg+O2↑ 2Mg+O2↑
2Mg+O2↑